
【题目】微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn=ZnO+2Ag,其中一个电极反应为Ag2O+H2O+2e-=2Ag+2OH-。

(1)判断正负极的材料。
负极材料_____________,正极材料___________。
(2)写出另一电极的电极反应式,并判断反应类型。
电极反应式__________
反应类型___________
(3)判断电池工作时,电子的流动方向和电解质溶液中离子的流动方向。电子由______到______,溶液中的阳离子流向电池的________,阴离子流向________
(4)在电池使用的过程中,电解质溶液中KOH的物质的量怎样变化?________(增大、减小、不变)
(5)当电池工作时通过电路对外提供了1 mol电子,计算消耗的负极的质量_______。
(6)氢氧燃料电池为绿色化学电源,在碱性NaOH溶液为电解质溶液时的负极电极反应式为______。
【答案】Zn Ag2O Zn+2OH--2e-=ZnO+H2O 氧化反应 负 正 正 负 不变 32.5g H2+2OH--2e-=2H2O
【解析】
总反应为Ag2O+Zn=ZnO+2Ag,其中一个电极反应为Ag2O+H2O+2e-=2Ag+2OH-,Ag2O变成Ag,Ag的化合价从+1变为0,化合价降低,则该电极反应化合价降低、被还原,是正极。
(1)由分析可知,Zn为负极,Ag2O为正极,故答案为:Zn;Ag2O;
(2)Ag2O+H2O+2e-=2Ag+2OH-为正极反应,负极失电子,被氧化,则负极反应为:Zn+2OH--2e-=ZnO+H2O,故答案为:Zn+2OH--2e-=ZnO+H2O;氧化反应;
(3)原电池中,电子由负极经导线流回正极,溶液中离子流向为阳离子流向正极,阴离子流向负极,故答案为:负;正;正;负;
(4)从总反应Ag2O+Zn=ZnO+2Ag来看,反应不涉及KOH,故答案为:不变;
(5)Zn-+2OH-+2e-=ZnO+H2O
65g 2mol
m 1mol 列式解得:m=32.5g
故答案为:32.5g;
(6)碱性氢氧燃料电池的负极反应式为:H2+2OH--2e-=2H2O,故答案为:H2+2OH--2e-=2H2O。


科目:高中化学 来源: 题型:
【题目】已知下列热化学反应方程式为
H2(g)+![]() O2(g)=H2O(l) △H1
O2(g)=H2O(l) △H1
C(s)+O2(g)=CO2(g) △H2
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H3
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H4
则△H4的正确表达式为
A. △H3-2△H1-2△H2B. 2△H1+2△H2-△H3
C. 2△H1-2△H2+△H3D. 2△H1-2△H2-△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性。
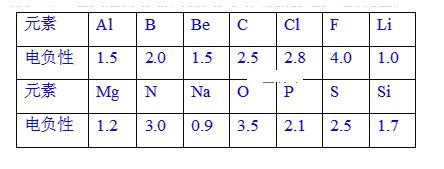
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是____。
(2)第3周期基态原子有2个未成对电子且电负性最大的元素是____(用元素符号表示)。
(3)下列化合物中属于共价化合物的是____。(Mg3N2、BeCl2、AlCl3、SiC)
(4)根据元素的电负性判断NCl3分子中Cl的化合价为____,已知水解反应前后各元素的化合价不变,则NCl3分子水解的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可再生能源是我国重要的能源资源,在满足能源需求、改善能源结构、减少环境污染、促进经济发展等方面具有重要作用。应用太阳能光伏发电技术是实现节能减排的一项重要措施。下列有关分析不正确的是( )
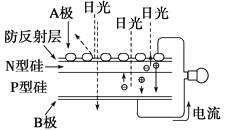
A.如上图是太阳能光伏发电原理图,图中A极为正极
B.风能、太阳能、生物质能等属于可再生能源
C.推广可再生能源有利于经济可持续发展
D.光伏发电能量转化方式是太阳能直接转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸参与热化学循环可通过二步循环或三步循环制取氢气,其中三步循环(碘硫热化学循环)原理如下图所示:

(1)“步骤Ⅰ.硫酸热分解”在恒容密闭容器中进行,测得各物质的物质的量分数与温度的关系如下图所示。其在650~1200℃间发生的主要反应的方程式为____。
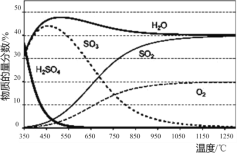
(2)“步骤Ⅱ.硫酸再生”的离子方程式为____(HI是强酸)。
(3)步骤Ⅲ的反应为2HI(g) ![]() H2(g) + I2(g) 。
H2(g) + I2(g) 。
①若在恒温恒容密闭容器中进行该反应,能说明已达到平衡状态的是___(填序号)。
a.容器内气体的总压强不再随时间而变化
b.n(HI)∶n(H2)∶n(I2)=2∶1∶1
c.反应速率:v(H2)正=v(H2)逆
d.I2(g)浓度不再随时间的变化而变化
②已知断裂(或生成)1mol化学键吸收(或放出)的能量称为键能。相关键能数据如下:
化学键 | H—I | H—H | I—I |
键能/kJ·mol-1 | 298.7 | 436.0 | 152.7 |
则该反应的![]() H为____kJ·mol-1。
H为____kJ·mol-1。
(4)将“三步循环”中步骤Ⅱ、Ⅲ用下图装置代替即为“二步循环”。
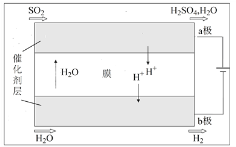
下列有关该装置的相关说法正确的是____(填序号)。
a.化学能转变为电能
b.催化剂可加快电极上电子的转移
c.反应的总方程式为SO2+2H2O ![]() H2+H2SO4
H2+H2SO4
d.每生成1molH2,电路中流过的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质![]() 括号内物质为杂质
括号内物质为杂质![]() ,所选用的试剂和分离方法都正确的是( )
,所选用的试剂和分离方法都正确的是( )
选项 | 物质 | 除杂试剂 | 分离方法或操作 |
A | 乙醇 | 无水 | 充分反应后蒸馏 |
B | 苯 | NaOH溶液 | 振荡静置后过滤 |
C | NaCl固体 | 水 | 高温溶解、降温结晶 |
D |
| 饱和 | 充分浸泡后过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 试分析比较合成氨与用SO2和O2反应制SO3的反应:
(1)某些相同点: ①△H ______ 0;②△S ______ 0(填<、=、>);③反应在 ______ 均能自发进行。
(2)条件选择中,主要的三方面不同点?并说明原因和理由?
①______;② ______;③______。
(3)请作出这类反应的“反应过程与能量变化”示意图________________________
Ⅱ.(4)SO2处理的一种方法是用石灰吸收(“钙基固硫”),其最终生成 ______ (写名称);
(5)实验室里可用“在浓氨水中加生石灰”的方法制取氨气,其理由是 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子排布式为3s23p4的粒子描述正确的是( )
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物
D.其电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应2Mg+CO2![]() 2MgO+C ΔH<0从熵变角度看,可自发进行
2MgO+C ΔH<0从熵变角度看,可自发进行
B.在密闭容器发生可逆反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7, Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com