
 臭氧层中氧分解历程如图所示,下列说法正确的是( )
臭氧层中氧分解历程如图所示,下列说法正确的是( )| A. | 催化反应①②均为放热反应 | |
| B. | 催化剂不能改变该反应的反应热 | |
| C. | ClO是该反应的催化剂 | |
| D. | 在该反应过程中没有化学键的断裂与生成 |
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.12mol | B. | 0.2mol | C. | 0.4mol | D. | 0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;B的结构简式是
;B的结构简式是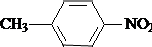 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 M和N单质燃烧时均放出大量热,可用作燃料.已知M和N均为短周期元素,其原子的第一至第四电离能如下表所示:
M和N单质燃烧时均放出大量热,可用作燃料.已知M和N均为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| M | 932 | 1821 | 15390 | 21771 |
| N | 738 | 1451 | 7733 | 10540 |
 ,MCl2是非极性(填“极性分子”或“非极性分子”);N的核外电子排布如图所示,该同学所画的电子排布图违背了能量最低原理.
,MCl2是非极性(填“极性分子”或“非极性分子”);N的核外电子排布如图所示,该同学所画的电子排布图违背了能量最低原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) $?_{500℃/30MPa}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 含 1mol NaOH的稀溶液分别和含1mol CH3COOH、1mol HNO3的稀溶液反应,后者比前者放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )| A. | 正极反应为:Zn-2e-→Zn2+ | B. | 盐桥中K+向右池移动 | ||
| C. | Pt电极上有气泡出现 | D. | 左烧杯中溶液的红色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10 mL 量筒量取5.25 mL盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH值为12.5 | |
| C. | 用托盘天平称取25.12g NaCl固体 | |
| D. | 配制70mL 0.1 mol/L的稀硫酸选用100 mL容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液, 振荡 | ① | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ②, 振荡 | ③ | 存在Fe2+ |
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com