
| A. | 肯定不含I- | B. | 肯定不含NH4+ | C. | 可能含有SO32- | D. | 肯定不含SO42- |
分析 无色溶液中加入溴水仍然无色,说明溴水发生了反应,且产物无色,I-和SO32-均可与溴水反应使溴水褪色,此时反应后溶液无色,说明没有I2,则原溶液中一定有SO32-;由于SO32-的还原性比I-强,故I-是否存在无法判断;因所有离子浓度相等,则根据电荷守恒可判断SO42-肯定没有,以此解答该题.
解答 解:加入溴水仍然无色,说明溴水发生了反应,且产物无色,I-和SO32-均可与溴水反应使溴水褪色,此时反应后溶液无色,说明没有I2,则原溶液中一定有SO32-,故C错误;
由于SO32-的还原性比I-强,故I-是否存在无法判断,故A错误;
因所有离子浓度相等,则根据电荷守恒可判断SO42-肯定没有,故D正确;
根据分析可知,无法判断是否含有铵根离子,故B错误;
故选D.
点评 本题考查常见离子的检验方法,题目难度不大,明确离子反应发生条件为解答关键,注意掌握离子共存的条件,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
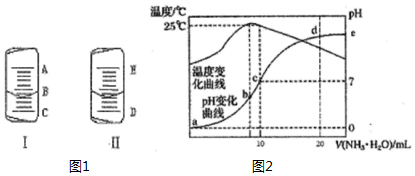 (1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.| 实验编号 | 待测CH3COOH溶液的体积/mL | NaOH溶液的体积/mL |
| 1 | 20.00 | 24.01 |
| 2 | 20.00 | 23.99 |
| 3 | 20.00 | 22.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
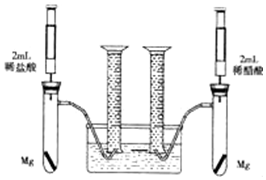 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 管道施工中,不能将铁制自来水管与铜制水龙头连接 | |
| B. | 化学反应过程中,一定有物质的变化,不一定有能量的变化 | |
| C. | 在配制的硫酸亚铁溶液中常加入一定量的铁粉和硫酸 | |
| D. | 已知C(石墨,s)═C(金刚石,s )△H>0,则石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③⑤ | C. | ③④⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入2molNH3反应达平衡时共吸收92.4kJ的热量 | |
| B. | 若转移1.5mol电子,则消耗0.75mol的H2 | |
| C. | 当V正(N2)=3V逆(H2)时,反应达到平衡 | |
| D. | 当反应达到平衡时,增大压强,V逆减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈红色的溶液中:S2O32-、Al3+、C2O42-、SO42- | |
| B. | Kw/c(H+ )=0.1mol•L-1的溶液:K+、Na+、CO32-、NO3- | |
| C. | 0.1mol•L-1 AgNO3溶液:H+、K+、SO42-、I- | |
| D. | 无色溶液中:Cr2O72-、NH4+、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
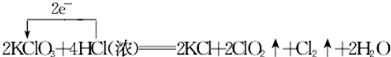 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com