
分析 (1)用惰性电极电解饱和食盐水时,阴极上水得电子生成氢气同时生成NaOH,阳极上氯离子失电子生成氯气;
(2)电池反应式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,根据反应式知,每生成2mol气体则生成2molNaOH,电解一段时间后共收集到11.2L(标准状况)气体,生成气体的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,则生成NaOH0.5mol,根据c=$\frac{n}{V}$计算c(NaOH);
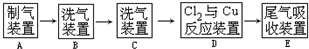
(3)实验室用浓盐酸和二氧化锰加热制取氯气,因为浓盐酸具有挥发性,所以得到的氯气中含有HCl,用饱和是食盐水除去氯气中的HCl,然后用浓硫酸干燥氯气得到较纯净、干燥的氯气,D中氯气和Cu在点燃条件下反应生成氯化铜,因为氯气有毒,则不能直接排空,应该用碱液处理尾气.
解答 解:(1)用惰性电极电解饱和食盐水时,阴极上水得电子生成氢气同时生成NaOH,阳极上氯离子失电子生成氯气,电池反应离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(2)电池反应式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,根据反应式知,每生成2mol气体则生成2molNaOH,电解一段时间后共收集到11.2L(标准状况)气体,生成气体的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,则生成NaOH0.5mol,c(NaOH)=$\frac{n}{V}$=$\frac{0.5mol}{10L}$=0.05mol/L,
故答案为:0.05mol/L;
(3)实验室用浓盐酸和二氧化锰加热制取氯气,因为浓盐酸具有挥发性,所以得到的氯气中含有HCl,HCl极易溶于水,氯化钠抑制氯气溶解,所以用饱和是食盐水除去氯气中的HCl,浓硫酸具有吸水性且和氯气不反应,所以用浓硫酸干燥氯气得到较纯净、干燥的氯气,D中氯气和Cu在点燃条件下反应生成氯化铜,因为氯气有毒,则不能直接排空,应该用碱液处理尾气.
①A中发生反应的化学反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+2H2O+Cl2↑,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+2H2O+Cl2↑;
②HCl极易溶于水,氯化钠抑制氯气溶解,所以用饱和是食盐水除去氯气中的HCl,浓硫酸具有吸水性且和氯气不反应,所以用浓硫酸干燥氯气得到较纯净、干燥的氯气,则B中选用的试剂是饱和食盐水,C中选用的试剂是浓硫酸,故答案为:饱和食盐水;浓硫酸;
③E中盛放碱液,氯气和碱液反应即E中反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H20,故答案为:Cl2+2OH-=Cl-+ClO-+H20.
点评 本题考查物质制备,为高频考点,涉及实验室和工业制取氯气,明确实验原理、物质性质是解本题关键,侧重考查学生实验设计、实验分析能力,知道(3)题流程图中气体成分及发生的反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 煤的气化、液化、干馏以及石油的分馏、裂化、裂解均属化学变化 | |
| B. | 煤燃烧时加入适量石灰石,可形成石膏,从而减少废气中SO2的含量 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开展废电池的回收利用 | |
| D. | 用秸秆发酵产生沼气,作家庭燃气,符合低碳经济的要求 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的浓度不再发生变化 | B. | 消耗Z的速率是生成X的速率的2倍 | ||
| C. | 气体总质量保持不变 | D. | X、Y、Z的分子数之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一主族元素的原子序数的差不可能为10 | |
| B. | 同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1 | |
| C. | 催化剂一般在金属与非金属的分界线处寻找 | |
| D. | 过渡元素全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极产生的Cl2进入阳极室 | |
| B. | 用水可以一次性鉴别硝基苯、甲苯、冰醋酸三种物质 | |
| C. | 制硫酸和氢氧化钠:用如图所示装置 (注:b为阴离子交换膜、c为阳离子交换膜) (注:b为阴离子交换膜、c为阳离子交换膜) | |
| D. | 乙醛的氧化:在试管里加入10%的NaOH溶液2 mL,滴入2%的CuSO4溶液4滴~6滴,振荡后加入乙醛溶液0.5 mL,加热至沸腾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X元素原子基态时的电子排布式为[Ar]4s24p3 | |
| B. | X元素是第四周期第ⅤA族元素 | |
| C. | Y元素原子的电子排布式为 | |
| D. | Z元素具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com