
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)。
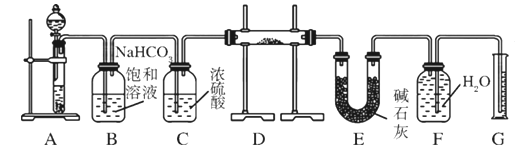
请回答下列问题:
(1) 装置A中的液体试剂选用 。
(2) 装置B的作用是 ,装置E中碱石灰的作用是 。
(3) 装置D中发生反应的化学方程式是: 、 。
(4) 若开始时测得样品的质量为2.0 g,反应结束后测得生成气体的体积为224 mL(标准状况),则试样中Na2O2的纯度为 。
【答案】(1) 6mol/L盐酸(2)除去气体中的HCl;吸收装置D中反应剩余的CO2
(3)2Na2O2+2CO2=2Na2CO3+O2 Na2O+CO2=Na2CO3 (4)78%
【解析】
试题分析:(1)装置A是制取CO2的,所以A中的液体是6mol/L盐酸。
(2)浓盐酸易挥发,由于氯化氢能和氧化钠或过氧化钠反应,从而干扰实验,所以装置B的作用是除去气体中的HCl。在反应中CO2是过量的,所以碱石灰的作用是吸收装置D中反应剩余的CO2。
(3)氧化钠和过氧化钠都能和CO2反应,所以反应的方程式是2Na2O2+2CO2===2Na2CO3+O2、Na2O+CO2===Na2CO3。
(4)根据题意可知,生成的氧气是0.01mol,则过氧化钠的物质的量是0.02mol,质量是1.56g,所以样品中过氧化钠的质量分数是1.56÷2×100%=78%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以下关于甲烷的说法中错误的是
A. 甲烷分子具有正四面体结构
B. 甲烷化学性质比较稳定,不被任何氧化剂氧化
C. 甲烷分子中具有极性键
D. 甲烷分子中四个C—H键是完全等价的键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列叙述正确的是( )
A.1molFe溶于过量稀硝酸,电子转移数为2NA
B.标准状况下,2.24LCCl4含有分子的数目为0.1NA
C.46gNO2和N2O4混合气体中含有原子总数为3NA
D.1L0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
回答下列问题:
(1)B的结构简式为 ,D 的化学名称为 。
(2)①和③的反应类型分别为 、 。
(3)E的结构简式为 。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为
。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式 。
(6)写出用2苯基乙醇(![]() )为原料(其他无机试剂任选)制备化合物D的合成路线。
)为原料(其他无机试剂任选)制备化合物D的合成路线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项属于碳链异构的是( )
A.CH3CH2CH2CH3和CH3CH(CH3)2
B.CH2═C(CH3)2和CH3CH═CHCH3
C.CH3CH2OH和CH3OCH3
D.CH3CH2CH2COOH和CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再利用。某校研究小组尝试回收废旧正极材料中的钴。
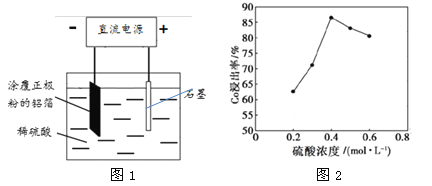
(1)钴酸锂(LiCoO2)改写为氧化物形式为 。
(2)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、 。阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol·L-1时,钴的浸出率下降,其原因可能为 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。
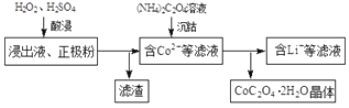
①写出“酸浸”过程中正极粉发生反应的化学方程式 。该过程中也可以用Na2S2O3代替H2O2,则反应的离子方程式为 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
A.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
B.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(C2O42-)
C.c(NH4+)+c(NH3H2O )=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
(4)已知所用锂离子电池的正极材料为xg,其中LiCoO2(M=98g·mol-1)的质量分数为a%,则回收后得到CoC2O42H2O(M=183g·mol-1)的质量不高于 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一。其工艺流程如下:
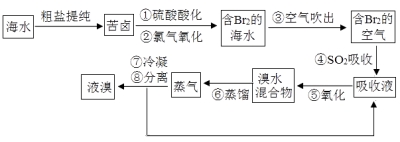
(1)步骤①中氯气氧化溴离子时在pH=3.5的酸性条件下效果最好,当使用精确pH试纸(能读数到0.1)检测步骤②氯气氧化的溶液的pH时,发现其颜色变化失常,则pH检测失败的原因是 。
(2)步骤④中反应的化学方程式为 ,该反应中体现了SO2的 性(填“氧化”或“还原”)。
(3)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,在实验室可用分液漏斗进行分离。分离时从分液漏斗的上口倒出的是 。
(4)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的 过程,与直接蒸馏含Br2的海水相比优点是消耗更少成本降低和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①CO2的大量排放会加剧温室效应
②正常雨水的pH为5.6,主要是因为溶解了SO2
③利用太阳能、风能和氢能替代化石能源可以改善空气的质量
④含磷合成洗涤剂易于被细菌分解,不会导致水体污染
⑤为防止电池中的重金属离子污染土壤和水源,废电池要集中处理
A.①②③④⑤ B.②③⑤ C.①③⑤ D.①②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com