
【题目】Wilson病是一种先天性铜代谢障碍性疾病,D-青霉胺具有排铜作用,用以治疗或控制Wilson病症。D-青霉胺结构简式如图:
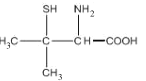
回答下列问题:
(1)写出Cu的简化电子排布式________。
(2)已知气态基态原子得到一个电子形成气态基态负一价离子所产生的能量变化称为该元素原子的第一电子亲合能(吸收能量为负值,释放能量为正值),试解释碳原子第一电子亲合能较大的原因 _________。 第一电子亲合能可能为正值或负值,而第二电子亲合能均为负值,原因是_____。
(3)D-青霉胺中,硫原子的VSEPR模型为____,碳原子的杂化方式为_______。
(4)请简述D-青霉胺能溶于水的主要原因________。
(5)青霉胺在临床治疗时对于症状改善较慢,常有并发症出现,因而近年采用锌剂(ZnSO4)替代治疗,可由硫化锌制备。立方硫化锌晶胞与金刚石晶胞类似,结构如图
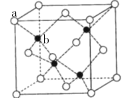
其中a代表S2-,b代表Zn2+。则该晶胞中S2-的配位数为______,若晶体的密度为ρg·cm-3,则晶胞的体积为________ cm3(列出计算式)。
【答案】[Ar]3d104s1 碳原子 2p 能级有两个电子,得到一个电子后 2p 能级为半充满,能量低更稳定 原子得到一个电子后显负电性,若要再得电子会有较大的排斥力,需要吸收能量 四面体形 sp2、sp3 D-青霉胺中的羧基、氨基能与水分子间形成氢键 4 (65+32)×4/ρNA
【解析】
(1)Cu为29号元素,其简化电子排布式为[Ar]3d104s1;
(2)碳原子 2p 能级有两个电子,得到一个电子后 2p 能级为半充满,能量低更稳定,所以碳原子第一电子亲合能较大;原子得到一个电子后显负电性,若要再得电子会有较大的排斥力,需要吸收能量,所以第二电子亲合能为负值;
(3)根据D-青霉胺的结构简式可知S原子与氢原子形成一个σ键,与碳原子形成一个σ键,同时还有两对孤电子对,所以为sp3杂化,VSEPR模型为四面体形;形成羧基的碳原子与氧原子形成一个碳氧双键,为sp2杂化,其他碳原子均为饱和碳原子,均为sp3杂化;
(4)D-青霉胺中的羧基、氨基均为亲水基,能与水分子间形成氢键;
(5)已面心的S2-为研究对象,每个晶胞内部有2个距离S2-相等且最近的Zn2+,所以该晶胞中S2-的配位数为4;根据均摊法,该晶胞含有S2-个数为![]() =4,含有Zn2+的个数为4,所以晶胞的质量m=
=4,含有Zn2+的个数为4,所以晶胞的质量m=![]() ,所以晶胞的体积V=
,所以晶胞的体积V=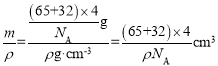 。
。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1 mol·L-1NaNO3溶液:H+、Fe2+、Cl-、SO42-、K+
B. ![]() =10-13mol·L-1的溶液:Na+、AlO2-、OH-、NO3-
=10-13mol·L-1的溶液:Na+、AlO2-、OH-、NO3-
C. 0.1 mol·L-1NH3·H2O溶液:K+、Na+、NO3-、Cl-
D. 加入铝粉能产生大量H2的溶液:Na+、K+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵是一种常见的强氧化剂,常用作火箭发射的推进剂。根据下列信息回答问题:
已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。
(1)写出高氯酸铵受热分解的化学反应方程式: _____________,Mg3N2的电子式为________。
(2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。)
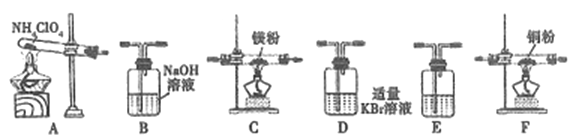
①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:_______。
②请按气流由左至右的方向连接装置:A →E→D →B→______→_____→_______→E (选择B~F装置,并用B~F字母填空)。
③证明产物中有Cl2的实验现象:________。
④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:________%。
(3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下:

步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤2:准确量取40.00mL 约0.1mol/L H2SO4于锥形瓶中。
步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。
步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤6:重复实验2~3次。
回答下列问题:
①步骤2中,准确量取40.00ml H2SO4 溶液的玻璃仪器是: __________。
②为获得样品中NH4ClO4的含量,还需补充的实验是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 为原子序数依次增大的短周期元素。A、C处于同一主族,C、D、E 处于同一周期,E 原子的最外层电子数是 A、B、C原子最外层电子数之和。A、B 组成的常见气体 X 能使湿润的红色石蕊试纸变蓝;D 的单质既能与C元素最高价氧化物的水化物的溶液反应生成盐,也能与A、E 形成的化合物的水溶液反应生成盐。下列说法正确的是( )
A.原子半径的大小顺序:C>D>E>A>B
B.C、E组成的化合物M 用右图装置进行电解能得到大量的 E 单质
C.元素B、E的最高价氧化物对应的水化物的酸性:B>E
D.C元素的氧化物中阴、阳离子数目之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害冷水系统的金属抑制剂。如图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有__。(写出两种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的氧化产物是__(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__。钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为__。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?__。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)“重结晶”过程的具体操作是:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
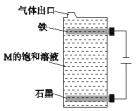
【题目】高铁酸钾(K2FeO4)是一种新型非氯高效消毒剂,微溶于KOH溶液,热稳定性差。实验室制备高铁酸钾的原理为3Cl2+2Fe(OH)3+10KOH==2K2FeO4+6KCl++8H2O。下列实验设计不能达到实验目的的是
A.用图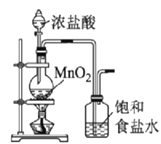 所示装置制备并净化氯气
所示装置制备并净化氯气
B.用图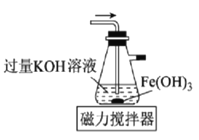 所示装置制备高铁酸钾
所示装置制备高铁酸钾
C.用图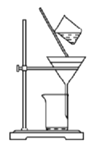 所示装置分离出高铁酸钾粗品
所示装置分离出高铁酸钾粗品
D.用图 所示装置干燥高铁酸钾
所示装置干燥高铁酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是
A | B | C | D |
|
|
|
|
烧杯中产生白色沉淀,一段时间后沉淀无明显变化 | 加盐酸出现白色浑浊,加热变澄清 | KMnO4 酸性溶液在苯和甲苯中均褪色 | 液体分层,下层呈 无色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是
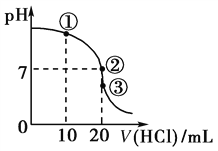
A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com