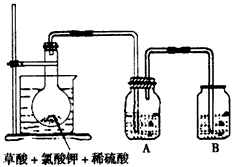
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,易溶于水,易与碱液反应,其性质非常不稳定,温度过高或二氧化氯的水溶液质量分数高于30%时均有可能引起爆炸。实验室制备ClO2的装置和方法如下图所示
回答下列问题:
(1)已知:用上述装置制备ClO2时,反应后的产物中有ClO2、CO2和一种酸式盐,则该反应的化学方程式为________________________
(2)在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其保持在60~ 80℃之间。这样操作的 目的是________________,图示装置中缺少的一种必需的玻璃仪器是_____________。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放___(填序号)。
a.50 mL 60℃的温水 b.50 mL冰水 c.50 mL饱和食盐水 d.50 mLNaOH溶液
(4)为了测定反应生成的ClO2的质量,设计了如下实验:将A中溶液全部转移到锥形瓶中,在锥形瓶中加入足量的KI和稀硫酸(已知:ClO2能将I-氧化为I2,其还原产物为Cl-);再用浓度为cmol/L的Na2S2O3标准溶液滴定反应生成的I2(发生的反应为I2+2S2O32-=2I-+S4O62-),共用去VmL Na2S2O3溶液。
①ClO2将I-氧化的离子方程式为:_____________________。
②实验中加入的指示剂为__________,滴定终点的现象为_______________。
③测得ClO2的质量m(ClO2)=_________(用含c、V的代数式表示)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案