
【题目】已知室温时,0.1 molL-1 某一元酸HA 在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的 pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为 1×10-7
D.由 HA 电离出的 c(H+)约为水电离出的 c(H+)的106倍
【答案】B
【解析】
试题分析:A.室温时,0.1 molL-1 某一元酸HA 在水中有0.1%发生电离,则c(H+)=0.1 molL-1×0.1%=10-4mol/L,所以溶液的pH=4,正确;B.升高温度,会使HA的电离平衡正向移动,c(H+)增大,因此会导致溶液的pH减小,错误;C.在室温下此酸的电离平衡常数![]() ,正确;D. 根据选项A分析可知由HA 电离出的 c(H+)=10-4mol/L,由于水的离子积常数是10-14,所以水电离出的 c(H+)=10-14÷10-4=10-10,所以酸HA电离产生的c(H+) 约为水电离出的 c(H+)10-6÷10-10= 106倍,正确。
,正确;D. 根据选项A分析可知由HA 电离出的 c(H+)=10-4mol/L,由于水的离子积常数是10-14,所以水电离出的 c(H+)=10-14÷10-4=10-10,所以酸HA电离产生的c(H+) 约为水电离出的 c(H+)10-6÷10-10= 106倍,正确。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2C12)是工业上常用的硫化剂。常温下是一种液体,沸点137℃,易与水反应。实验室可通过硫与少量氯气在110140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。
(1)选取以下装置制取少量S2Cl2:

①仪器m的名称为_____________。
②装置连接顺序:A→________________________________→E→D。
③A中发生反应的离子方程式为 _________________________。
④装置F的作用是____________________。
⑤D中的最佳试剂是__________(填标号)。
a.碱石灰 b.浓硫酸 c.无水氯化钙
⑥为了提高S2Cl2的纯度,关键的是控制好温度和_______________________。
(2)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合物的SO2的体积分数。

①W溶液可以是下列溶液中的__________(填标号);
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为__________(含V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是
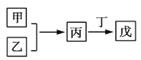
A. 若甲既能与盐酸反应又能与NaOH溶液反应则丙可能属于两性氧化物
B. 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
C. 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
D. 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左侧充入1 mol N2,右侧充入CO和CO2的混合气体共8 g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是
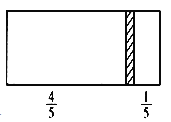
A.右侧CO与CO2分子数之比为1∶3
B.右侧气体密度是相同条件下氢气密度的18倍
C.右侧CO的质量为1.75 g
D.若隔板处于距离右端1/6处,其他条件不变,则前后两次压强之比为25∶24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。

(1)写出各有机物的名称:
A ________________ ;B _____________________;C ____________________ ;
D ________________ ;E ____________________。
(2)写出加入的试剂
(a)是_________________________;(b)是___________________________。
(3)写出有关的操作分离方法
①是_________________,②是__________________,③是__________________。
(4)写出C→D 反应的化学方程式 _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g) ![]() Z(g)+W(s) ΔH>0。下列叙述中,正确的是( )
Z(g)+W(s) ΔH>0。下列叙述中,正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如下图装置研究电化学原理,下列说法中错误的是
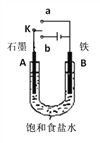
A. 若开始时开关K与a连接,其反应与铁的吸氧腐蚀类似
B. 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol
C. 若开始时开关K与b连接,则该装置是化学能转变为电能
D. 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是
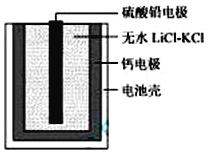
A.正极反应式:Ca + 2Cl--2e- = CaCl2
B.放电过程中,Li+向负极移动
C.常温时,在正负极间接上电流表或检流计,指针发生偏转
D.每转移0.1mol电子,理论上生成10.35 g Pb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com