
| A、钠与水反应 Na+H2O═Na++OH-+H2↑ |
| B、AlCl3溶液中加过量氨水 Al3++3OH-═Al(OH)3↓ |
| C、向氯化亚铁中通入氯气 Fe2++Cl2═Fe3++2Cl- |
| D、铝粉投入到NaOH溶液2Al+2OH-+2H2O═2 AlO2-+3H2↑ |


科目:高中化学 来源: 题型:
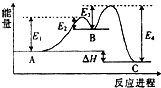 某反应由两步反应ABC构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能),下列有关叙述正确的是( )
某反应由两步反应ABC构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能),下列有关叙述正确的是( )| A、两步反应均为吸热反应 |
| B、加入催化剂会改变反应的焓变 |
| C、三种化合物中C最稳定 |
| D、整个反应中△H=E1-E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向CuSO4溶液中加入适量铁粉 |
| B、等物质的量浓度、等体积的FeCl3与KI溶液混合 |
| C、等物质的量的NaHCO3与Na2O2溶于水 |
| D、在Na2SiO3溶液中通入过量CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaNO2发生氧化反应 |
| B、NH4Cl中的氮元素被还原 |
| C、N2既是氧化产物,又是还原产物 |
| D、每生成1mol N2转移电子的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混用会导致氯气中毒:ClO-+Cl-+2H+═Cl2↑+H2O |
| B、水壶中水垢用食醋除去:2H++CaCO3═Ca2++CO2↑+H2O、 |
| C、SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH═Na2SO4+H2O |
| D、用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
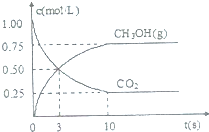 目前工业上可用CO2来生产燃料甲醇,其反应方程式为:CO2(g)+
目前工业上可用CO2来生产燃料甲醇,其反应方程式为:CO2(g)+| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,向20mL 0.2mol?L-1 H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2- ).根据图示判断,下列说法正确的是
常温下,向20mL 0.2mol?L-1 H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2- ).根据图示判断,下列说法正确的是| A、当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B、等体积等浓度的NaOH溶液与H2A溶液混合后其溶液中水的电离程度比纯水大 |
| C、A点溶液显中性 |
| D、向NaHA溶液加入水的过程中,pH可能增大也可能减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com