
| A、加水稀释过程中,c(H+):c(OH-) 的值增大 | ||
| B、根据以上信息,可推断NH3?H2O为弱电解质 | ||
C、与pH=11.12的 NaOH溶液相比,NaOH溶液中c(Na+) 大于氨水中c(NH
| ||
| D、加入少量NH4Cl 固体,溶液中水的电离平衡:H2O?H++OH-正向移动 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

| Mg |
| THF |
| BrR2 |
| Li,THF室温 |
| H3O+ |
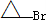 是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有
是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有 的有机反应类型
的有机反应类型| NaOH水溶液 |
| △① |
| HBr |
| ② |
| Cu,O2,△ |
| ③ |
| 新制Cu(OH)2 |
| △④ |
| 酸化 |
| ⑤ |
| -HBr |
| ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu与Cu2O的物质的量之比为2:1 |
| B、硝酸的物质的量浓度为2 mol/L |
| C、Cu、Cu2O与硝酸反应后剩余HNO3的物质的量为0.5mol |
| D、产生的NO在标准状况下的体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅材料广泛用于光纤通讯 |
| B、工艺师利用盐酸刻蚀石英制作艺术品 |
| C、粗硅制备单晶硅不涉及氧化还原反应 |
| D、水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解MgCl2溶液可制金属镁 |
| B、可溶性铁盐或铝盐可用于水的净化 |
| C、在海轮外壳上装上锌块,可减缓船体的腐蚀速率 |
| D、“开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
c(N
| ||
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(H+) | ||
c(N
|
| c(OH-) |
| c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com