
����Ŀ��ǿ����ǿ���ϡ��Һ��Ӧ���Ȼ�ѧ����ʽΪH��(aq)��OH��(aq)===H2O(l) ��H����57.3 kJ��mol��1����1L0.5mol��L��1��NaOH��Һ�м����������ʣ���ϡ���ᡢ��Ũ���ᡢ��ϡ���ᣬǡ����ȫ��Ӧ����ЧӦ�ֱ�Ϊ��H1����H2����H3�����ߵĹ�ϵ��ȷ���ǣ� ��
A.��H1>��H2>��H3B.��H1<��H3<��H2
C.��H1����H3>��H2D.��H1>��H3>��H2
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������б仯�У������ڻ�ѧ�仯���ǣ� ��
A. SO2ʹƷ����Һ��ɫ B. ��ˮʹ��ɫʯ����Һ��ɫ
C. SO2ʹ���������Һ��ɫ D. ����̿ʹīˮ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaClO2����һ�ָ�Ч��Ư������������������������������NaCl���ų�ClO2��ClO2������Cl2�����ʡ�ij��ȤС��̽���������Ƶ��Ʊ������ʡ�
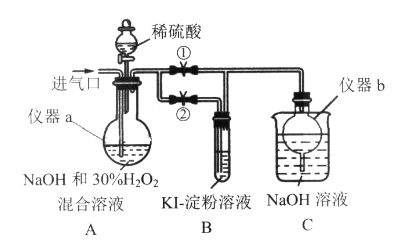
���Ʊ���������
�ر�ֹˮ�Тڣ���ֹˮ�Т٣��ӽ�����ͨ������ClO2����ַ�Ӧ��
��1������a������Ϊ______________������b��������______________��
��2��װ��A������NaClO2�����ӷ���ʽΪ____________________________��
��3������װ��A��Ӧ�����Һ�л��NaClO2���壬����Ҫ�����м�ѹ����Ũ�������½ᾧ������ _____����ȡ�
��̽���������Ƶ�����
ֹͣͨClO2���壬��ͨ�����һ��ʱ��ر�ֹˮ�Т�,��ֹˮ�Тڣ���A�е���ϡ���ᡣ
��4��B������Ϊ____________________________________ ��
��5��ʵ����ɺ�Ϊ��ֹװ�����������ж�������Ⱦ���������Խ��еIJ����ǣ��ٴδ�ֹˮ�Т٣�_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ�Լгֺ;���װ�ã����ô�װ�úͱ����ṩ��������������ʵ�����
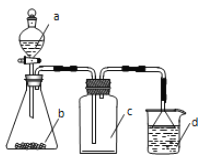
ѡ�� | a������ | b������ | c�е����� | d������ |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | ϡ���� | Cu | NO | H2O |
C | ���� | Na2CO3 | CO2 | NaOH��Һ |
D | Ũ���� | MnO2 | Cl2 | NaOH��Һ |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������������ڷ�Ӧ������������ǣ� ��
A. �������������ķ�ӦB. �Ȼ����Ba(OH)2��8H2O��Ӧ
C. пƬ��ϡ���ᷴӦD. ������ˮ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2CO3��NaHCO3�����Һ����μ���ϡ���ᣬ�����������������������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ������������ ��

A��a���Ӧ����Һ�У�Na����OH����SO42-��NO3-
B��b���Ӧ����Һ�У�K����Ca2����MnO4-��Cl��
C��c���Ӧ����Һ�У�Na����Ca2����NO3-��Cl��
D��d���Ӧ����Һ�У�F����NO3-��Fe2����Ag��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��ͬѧ��ʵ������±���Ʊ�����Mg(ClO3)2��6H2O����������ͼ��ʾ��
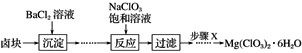
��֪����±����Ҫ�ɷ�ΪMgCl2��6H2O������MgSO4��FeCl2�����ʡ�
�����ֻ�������ܽ��(S)���¶�(T)�ı仯������ͼ��ʾ��
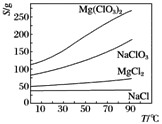
���γ������������ʱ����ͬ���Ӷ�Ӧ��Һ��pH���£�Fe2����ʼ������pHΪ5.8����ȫ������pHΪ8.8��Fe3����ʼ������pHΪ1.1����ȫ������pHΪ3.2��Mg2����ʼ������pHΪ8.2����ȫ������pHΪ11��
�ܿ�ѡ�õ��Լ���H2O2��ϡ���ᡢKMnO4��Һ��MgCl2��Һ��MgO��
(1)����X�����IJ���Ϊ___________�� ___________��____________������ϴ�Ӳ����
(2)����BaCl2��Һ�������辭������ʵ�鲽��Ž����²���Ӧ����д��������ʵ�鲽�裺
��________________________________________________________________________��
�� _______________________________________________________________________��
(3)����NaClO3������Һ������Ӧ�Ļ�ѧ����ʽΪ_______________________________��
(4)��Mg(ClO3)2���뵽����KSCN��FeSO4��Һ���������ֺ�ɫ��д����ط�Ӧ�����ӷ���ʽ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨH3BO3������Ӧ���ڲ���������ҵ������þ��2MgOB2O3H2O��SiO2������Fe3O4��CaCO3��Al2O3��Ϊԭ����������Ĺ���������ͼ��

��֪��i��Fe3+��Al3+��Fe2+��Mg2+������������ʽ��ȫ����ʱ����Һ��pH�ֱ�Ϊ3.2��5.2��9.7��12.4��
����H3BO3��20�桢40�桢60�桢100��ʱ���ܽ������Ϊ5.0g��8.7g��14.8g��40.2g��
��1��Ϊ�������þ��۵Ľ����ʣ��ɲ�ȡ�Ĵ�ʩ��___________�����ٴ���������
��2��������Һ�������ԣ���H3BO3��Mg2+��SO42����������Fe3+��Fe2+��Ca2+��Al3+�����ʣ������ӡ�ʱ�����Һ�����μ�������H2O2��MgO��H2O2��������_______________________ �������ӷ���ʽ��ʾ����MgO��ȥ������������____________________��
��3����֪H3BO3�������NaOH��Ӧ����Na[B��OH��4]����д��H3BO3����Һ�еĵ��뷽��ʽ_______________________��
��4������ȡ�����á��ȹ��ˡ���Ŀ����______________��ĸҺ�е���Ҫ������___________��___________����Ҫ�����֣���
��5���ⶨ���ò�Ʒ�Ĵ��ȣ�ȡa g���ᣬС�ļ���ʹ��ֽ���ȥˮ�֣��������Ȳ��ֽ⣩���ò�������b g�����Ʒ�Ĵ���Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������������ʱ����Ӧ������Ӧ�������ı䣬��������û��Ӱ�����
A. Na��O2 B. NaOH��Һ��CO2
C. Na2O2��CO2 D. AlCl3��Һ��NaOH��Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com