
(10分)通常空气中CO允许浓度是<5 × 10-6,最高可忍受的水平是50 × 10-6。在甲烷燃烧器里常发生如下反应:CH4(g) + 2O2(g) = CO2(g) + 2H2O (g) (A)
CH4(g) + 3/2O2(g) = CO(g) + 2H2O (g) (B)
当燃烧器的调节不当时有引起CO中毒的危险。现已知下列数据(298K,PΘ下):
物质 | CH4 (g) | O2 (g) | CO2(g) | CO(g) | H2O(g) |
ΔfΗΘm (kJ/mol) | -74.9 | 0 | -393.6 | -110.5 | -241.8 |
SΘm (J/mol∙K) | 186.2 | 205.0 | 213.6 | 197.6 | 188.7 |
并已知下列有关公式:ΔrGΘm=ΔrΗΘm -TΔr SΘm; ΔrGΘm= -RTlnKΘ
请求算并解答下列问题:
(1) 假设ΔfΗΘm、SΘm的数值均不随温度发生变化,试计算T=1500K下反应的(A)、(B)的ΔrGΘm(A)、ΔrGΘm(B)
(2) 求反应(A)、(B)在1500K下的标准平衡常数KΘA、KΘB
(3) 由(2)题得出的信息说明下列问题:
① 该条件下,(A)、(B)反应是否完全?达平衡时有人认为n(CH4) ≈ 0,是否合理?
② 平衡时,n(CO2)和n(CO)之间的关系如何?(写出>,< 或>>,<<)
(4) 当反应条件在T=1500K,PΘ时,进入燃烧器的空气量维持物质的量的比例CH4:O2 =1:2,当达到平衡时,CO的物质的量分数x(CO)为7.6× 10-5;若反应前后总物质的量可视为不变。请计算当燃烧产生的烟中的水蒸气从1500K冷却到室温后,水蒸汽凝结,致使气相中的总物质的量由n总 =11变成n总 =9,此时烟里的CO的浓度x′(CO)为多少?(用10-6表示)有CO中毒的危险吗?。
(1) 对A反应 ΔrΗΘm(A) =ΔfΗΘm(CO2,g) + 2ΔrΗΘm(H2O,g)ΔfΗΘm(CH4,g)
= -802.2(kJ/mol)
ΔrSΘm(A) = SΘm (CO2,g) + 2 SΘm (H2O,g) SΘm (CH4,g) 2 SΘm (O2,g)
= -5.2(J/mol∙K)
ΔrGΘm(A)=ΔrΗΘm(A)-TΔr SΘm(A) = -802.2 × 1000 1500 × (-5.2)
= -794500(J/mol)
同理对B反应 ΔrΗΘm (B) = -519.2(kJ/mol)
ΔrSΘm(B) = 81.3(J/mol∙K)
ΔrGΘm(B) = -641150(J/mol)
(2) lnK(A)Θ = -ΔrGΘm(A)/RT \ K(A)Θ = 4.62 × 1027
lnK(B)Θ = -ΔrGΘm(B)/RT \ K(B)Θ = 2.13 × 1022
(3) ①因K(A)Θ和K(B)Θ都很大,可视为反应十分完全,达平衡时n(CH4) ≈ 0合理。
②因K(A)Θ>> K(B)Θ \ n(CO2) >> n(CO)
(4) 因达平衡时气相中x(CO) = 7.06 × 10-5,则水蒸汽凝结后使气相中的物质的量的总数由n总 =11变成n总 =9。
\ x′(CO) = 7.06 × 10-5 × 11/9 = 86.3 × 10-6
此值大于50 × 10-6有引起中毒的危险


科目:高中化学 来源: 题型:
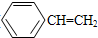 )是无色,带有辛辣气味的易燃液体,有毒.人体吸入过多的苯乙烯蒸气时会引起中毒,在空气中的允许浓度在1×10-4 kg?m-3以下.下列关于苯乙烯的性质推断中正确的是( )
)是无色,带有辛辣气味的易燃液体,有毒.人体吸入过多的苯乙烯蒸气时会引起中毒,在空气中的允许浓度在1×10-4 kg?m-3以下.下列关于苯乙烯的性质推断中正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
| 通电 | 一定条件 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年贵州省高三上学期期末考试化学试卷(解析版) 题型:填空题
(12分)下列三个反应在某密闭容器中进行:
反应①
Fe(s)+CO2(g) FeO(s)+CO(g) △H1="
a" kJ·mol-1
FeO(s)+CO(g) △H1="
a" kJ·mol-1
反应②
2CO(g)+O2(g) 2CO2(g) △H2=" b"
kJ·mol-1
2CO2(g) △H2=" b"
kJ·mol-1
反应③
2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1)则△H3= (用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.再通入CO2
C.升高温度 D.使用合适的催化剂
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为: 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省高三第一次月考理科综合化学部分试题 题型:填空题
(16分)在密闭容器中进行:
反应① Fe(s)+CO2(g)  FeO(s)+CO(g)
△H1= a kJ·mol-1
FeO(s)+CO(g)
△H1= a kJ·mol-1
反应② 2CO(g)+O2(g)  2CO2(g)
△H2= b kJ·mol-1
2CO2(g)
△H2= b kJ·mol-1
反应③ 2Fe(s)+O2(g)  2FeO(s)
△H3
2FeO(s)
△H3
(1)△H3= (用含a、b的代数式表示)
(2)反应①的化学平衡常数表达式K= ,已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为 ,CO的平衡浓度为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.再通入CO2
C.升高温度 D.使用合适的催化剂
(4)下列图像符合反应①的是 (填序号)(图中ν是速率、 为混合物中CO含量,T为温度)。
为混合物中CO含量,T为温度)。
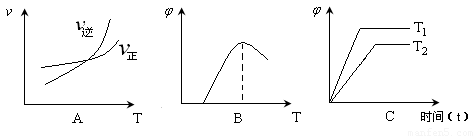
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com