


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
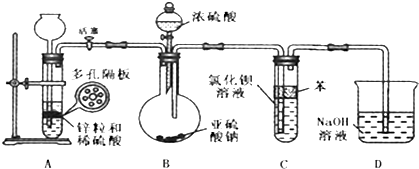
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、能使pH试纸呈红色的溶液:Na+、NH4+、Cl-、NO3- |
| B、滴入KSCN溶液显血红色的溶液:K+、Na+、CO32-、I- |
| C、能与铝反应产生H2的溶液:K+、Fe2+、Cl-、NO3- |
| D、常温下由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 )可由下列路线合成:
)可由下列路线合成: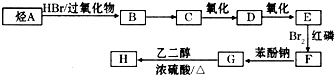
| HBr/过氧化物 |
| Br2/红磷 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
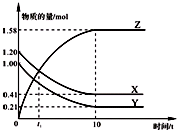 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A、反应开始到10 s,用Z表示的反应速率为0.158 mol/(L?s) |
| B、反应开始到10 s时,Y的转化率为79.0% |
| C、t1时,Z和X的浓度相等,达到了化学平衡状态 |
| D、反应的化学方程式为:X(g)+Y(g)?Z(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com