
 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
| A、混合物:空气、矿泉水、水银 |
| B、碱:Ba(OH)2、纯碱、NH3?H2O |
| C、盐:石灰石、氯化铵、NaHSO4 |
| D、酸性氧化物:CO2、CO、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
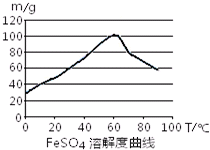 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4| n(Fe) |
| n(H2SO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 2010上海世博上,零排放、太阳能、绿色光源等成为高科技亮点.
2010上海世博上,零排放、太阳能、绿色光源等成为高科技亮点.查看答案和解析>>
科目:高中化学 来源: 题型:
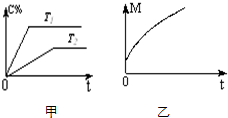 在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).
在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com