
【题目】在一定温度下,体积为2L的容器内M、N的物质的量随时间变化的曲线如图所示,下列说法不正确的是
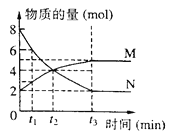
A. 反应方程式为2N ![]() M
M
B. 反应进行到t2时,达到平衡状态
C. 反应进行到t3时,N的物质的量浓度减少了3molL-1
D. 若t1=1,则0 ~t1时间段N的平均速率为2mol (Lmin) -1
【答案】BD
【解析】
A.根据图中知,反应中N减少,M增加,M、N物质的量变化量之比为1:2,在t3后两种物质的物质的量不再发生变化。则N为反应物,M为生成物,反应中各物质的物质量的变化之比等于化学计量数之比,该反应的化学方程式为2NM,A正确,不符合题意;
B.根据图中知,t2时各组分的物质的量还在变化,说明没有达到平衡,正、逆反应速率不相等,B错误,符合题意;
C.根据图示可知:在反应进行到t3时,N的物质的量减小了6mol,由于容器的容积为2L,所以N浓度减少了3mol/L,C正确,不符合题意;
D.0到t1,N的物质的量从8mol减少到2mol,时间为1min,体积为2L,则有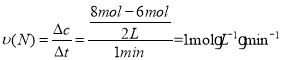 ,D错误,符合题意;
,D错误,符合题意;
故合理选项是BD。


科目:高中化学 来源: 题型:
【题目】用某种仪器量取液体体积时,平视时读数为x mL,仰视时读数为y mL,俯视时读数为z mL,若y<x<z,则所用仪器可能是( )
A. 酸式滴定管 B. 碱式滴定管 C. 量筒 D. 以上仪器都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下图所示实验,下列实验现象预测或操作正确的是
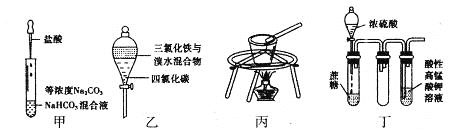
A. 实验甲:匀速逐滴滴加盐酸时,试管中没气泡产生和有气泡产生的时间段相同
B. 实验乙:充分振荡后静置,下层溶液为橙红色,上层为无色
C. 实验丙:用瓷坩埚融化NaOH
D. 装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CuSO4溶液和不同酸根离子形成的钠盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
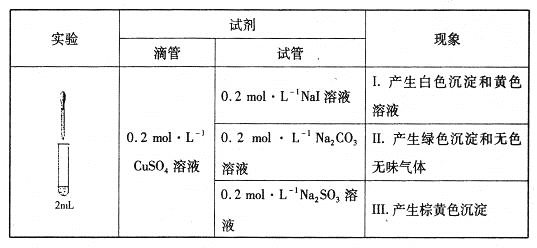
(1)经检验,现象I的白色沉淀为CuI,则反应的离子方程式为_____________________,氧化产物与还原产物的物质的量之比为____________。
(2)经检验,现象Ⅱ中产生的气体是二氧化碳,绿色沉淀是碱式碳酸铜[xCuCO3·yCu(OH)2·zH2O]。现采用氢气还原法测定碱式碳酸铜组成,请回答如下问题:
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式__________________________________________________;
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填仪器接口字母编号):a→_______→g f→____→_____→_____→l

(3)经检验,现象Ⅲ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。
已知:Cu+![]() Cu+Cu2+
Cu+Cu2+
①用稀硫酸证实沉淀中含有Cu+的实验现象是______________________________。
②通过下列实验证实,沉淀中含有Cu2+和SO32-
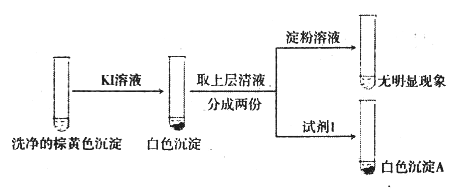
a.白色沉淀A是BaSO4,试剂1是_____________________。
b.证实沉淀中含有Cu+和SO32-的理由是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图是表示相应变化的能量关系图,其中正确的是( )
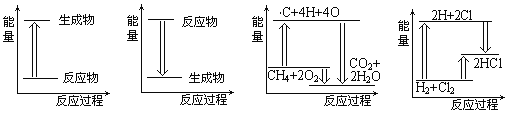
A. 锌与稀硫酸的反应 B. 植物的光合作用 C. 天然气燃烧 D. H2与Cl2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)是全球硫循环的重要中间体,也是有机合成中的重要原料,是化学工作者重要的研究对象。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △Hl=-17kJ/mol;
H2S(g)+CO(g) △Hl=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2=-35kJ/mol。
H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的△H=________。
H2(g)+CO2(g)的△H=________。

(2)在充有催化剂的恒压密闭容器中进行反应I。设起始充入的n(COS):n(H2)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示。
①m1________m2(填>、<或=)。
②温度高于T0时,COS转化率减小的可能原因为_________。
A.有副反应发生。 B.反应的△H增大。
C.催化剂活性降低。 D.逆反应速率增大的倍数大于正反应速率增大的倍数
(3)在恒温、恒容密闭容器中.进行反应I。下列说法中能说明反应I已达到平衡状态的是____。
A.c(H2S)=c(CO) B.v正(H2)=v逆(H2S)
C.容器中气体密度保持不变 D.容器中混合气体平均摩尔质量保持不变
E.c(COS)保持不变
(4)某温度下,向体积为2 L的恒容密闭容器中通入5 mol COS(g)和5 molH2O(g),发生反应Ⅱ,5 min后反应达到平衡,测得COS(g)的转化率为60%。
①反应从起始至5 min内,用H2S浓度变化表示的平均反应速度v(H2S)=________。
②该温度下,上述反应的平衡常数K=________。
③其他条件相同时,既能使上述反应中COS的平衡转化率增大,又能使反应速率加快的做法是________。
A.缩小容器容积 B.升高温度
C.分离出硫化氢 D.加入一定量H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下将1 mol CO和1 mol H2O(g)通入定容容器中反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6 mol,再通入4 mol H2O(g)达到平衡后CO2的物质的量可能是( )
CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6 mol,再通入4 mol H2O(g)达到平衡后CO2的物质的量可能是( )
A. 等于0.6 mol B. 等于1 mol C. 大于1 mol D. 大于0.6 mol,小于1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
A. 反应中硫酸作氧化剂
B. ![]() 中硫元素被氧化
中硫元素被氧化
C. 刺激性气味的气体是氨气
D. 1mol![]() 完全反应转移0.5mol电子
完全反应转移0.5mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com