
【题目】下列事故处理方法正确的是
A.电线短路失火时,用大量的水灭火
B.NaOH浓溶液溅到皮肤,立即用水冲洗,然后涂上稀硼酸溶液
C.浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤
D.钠着火时,立即用水灭火
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】红矾钠(Na2Cr2O7·2H2O)广泛用作强氧化剂、鞣革剂。以铬矿石(主要成分为Cr2O3,还含有FeO、Al2O3、SiO2等杂质)为原料制取红矾钠的流程如下:

已知:①CrO42-与Cr2O72-存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O,当pH<3时,以Cr2O72-为主,当pH>9时,以CrO42-为主。
Cr2O72-+H2O,当pH<3时,以Cr2O72-为主,当pH>9时,以CrO42-为主。
②钠盐在不同温度下的溶解度(g):
温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
Na2SO4 | 9.0 | 19.4 | 40.8 | 48.8 | 46.7 | 45.3 | 44.1 | 43.7 |
Na2Cr2O7 | 170.2 | 180.1 | 196.7 | 220.5 | 248.4 | 283.1 | 323.8 | 385.4 |
注32.38℃以上,与饱和溶液平衡的固相为无水Na2SO4,以下则为Na2SO4·10H2O。
③Cr3+完全沉淀时pH为6.8,Cr(OH)3开始溶解时pH为12。
请回答下列问题:
(1)煅烧铬矿石时,生成Na2CrO4的化学反应方程式为_________
(2)滤渣Ⅱ的成分是__________(填化学式)。
(3)有人认为工艺流程中“用稀硫酸调pH”改为“通入过量CO2”,不需调节pH同样可以达到实验效果,理由是___________。
(4)向红矾钠溶液中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到________
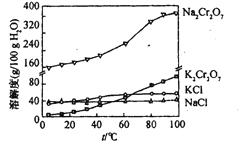
A.80 B.60 C.40 D.10
(5)该工艺所得副产品主要为无水硫酸钠并混有少量重铬酸钠,请设计从副产品获得芒硝(Na2SO4·10H2O)的实验方案:将该副产品按固液质量比100:230溶于热水,加入稍过量的Na2SO3溶液,搅拌,____,过滤,洗涤,低温干燥。(实验中须使用的试剂:稀H2SO4、NaOH溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠元素广泛存在于自然界,中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。下列关于含钠元素物质的说法错误的是
A. “稻草变黄金”的过程中元素种类没有改变
B. NaCl与Na2CO3灼烧时火焰颜色相同
C. 治疗胃酸过多可以用NaHCO3,糕点生产也可以用NaHCO3
D. 金属钠放置空气中,最终会变成Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为 0.20mol·L-1的 MgCl2 和 CaCl2 混合溶液中逐滴加入 Na3PO4,先生成沉淀________(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

已知: Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8 可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
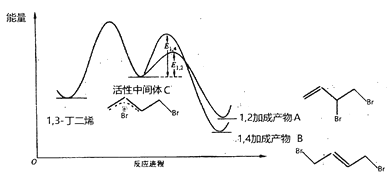
【题目】当1,3-丁二烯和溴单质1:1加成时,其反应机理及能量变化如下:
不同反应条件下,经过相同时间测得生成物组成如下表:
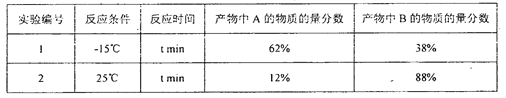
下列分析不合理的是
A. 产物A、B互为同分异构体,由中间体生成A、B的反应互相竞争
B. 相同条件下由活性中间体C生成产物A的速率更快
C. 实验1测定产物组成时,体系己达平衡状态
D. 实验1在t min时,若升高温度至25℃,部分产物A会经活性中间体C转化成产物B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是
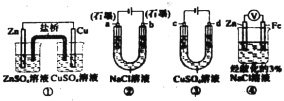
A. 装置①中,盐桥(含有琼胶的KCl饱和溶液)中的K+移向ZnSO4溶液
B. 装置②工作一段时间后,a极附近溶液的pH减小
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
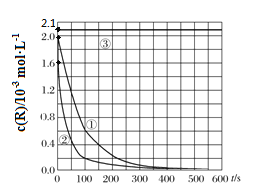
实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定不正确的是
pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定不正确的是
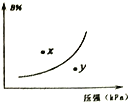
① m+n>p ②x点表示的正反应速率小于逆反应速率 ③n<p
④反应速率x点比y点时的慢 ⑤若升高温度,该反应的平衡常数减小
A. ②⑤ B. ②④ C. ①③ D. ①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com