
【题目】如图为直流电源电解饱和食盐水的装置。(a、b均为碳棒)
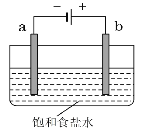
(1)a极的名称是__极,反应式为__。
(2)b极的电极反应式为__,发生__反应。
(3)写出电解饱和食盐水的化学方程式__。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学广泛应用于生产生活中,下列叙述正确的是( )
①钢铁制品被锈蚀主要是因为钢铁中含有碳,会发生原电池反应,因此生铁炼钢时要尽可能完全除去生铁中的碳
②海水淡化和生产生活废水的再利用,是解决缺水问题的有效途径
③高铁酸钠(![]() )和
)和![]() 都能作为净水剂,净水效果完全相同
都能作为净水剂,净水效果完全相同
④液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰
A.①②③B.②④C.②③④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L庚烷的分子数约为NA
B.1 L0.1mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
C.4.0 g![]() 与D2O的混合物中所含中子数为2NA
与D2O的混合物中所含中子数为2NA
D.50 mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的合金及其化合物在现代生产、生活中有着广泛的应用。如二氧化锰是重要的氧化剂、催化剂、干电池中的去极剂;硫酸锰是重要的微量元素肥料。
Ⅰ.某工厂以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料联合生产二氧化锰、硫酸锰晶体的工艺流程如下图所示:
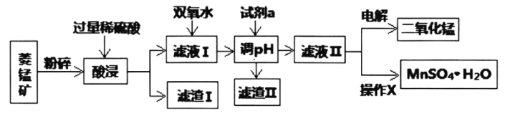
常温下几种金属氧化物沉淀时的pH:
Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时的pH | 7.2 | 2.7 | 4.7 |
完全沉淀时的pH | x | 3.7 | 6.7 |
(1)该工厂调pH时,选择试剂a的成分最好是________,滤渣Ⅱ的成分是________,操作X是________、洗涤、低温烘干。
(2)为确保除尽杂质而又不损失锰,pH调整的范围为________;若常温下离子(X)沉淀完全的标准是c(X)<1.0×10-5mol/L,Ksp[Mn(OH)2]=1.0×10-13,则使Mn2+完全沉淀时溶液的pH最小为________。
(3)若滤液Ⅱ显酸性,请写出电解法制备MnO2时阳极上的电极反应式:________。
Ⅱ.50.7g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化曲线)如下图所示。(已知:M(Mn)=55g/mol)
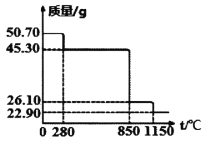
(1)850℃时,所得固体的化学式为:________________________。
(2)1150℃时,反应的化学方程式为:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯胺(NCl3)是一种饮用水二级消毒剂,可由以下反应制备:
Ⅰ.![]()
![]()
回答下列问题:
(1)已知:Ⅱ.![]()
![]()
Ⅲ.![]()
![]()
则![]() =________(用含
=________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)向容积均为2L的甲乙两个恒温密闭容器中分别加入4mol NH3和4mol Cl2,发生反应Ⅰ,测得两容器中n(Cl2)随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲(T1) | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙(T2) | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80min内,容器甲中v(NH3)=________________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于容器乙,下列说法正确的是________(填选项字母)。
A.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
B.反应进行到70min时,v正一定大于v逆
C.容器内气体平均相对分子质量在增大,说明平衡在正向移动
D.达平衡后,加入一定量NCl3(l),平衡逆向移动
E.达平衡后,按原投料比再充入一定量反应物,平衡后NH3的转化率增大
④温度为T1时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2L的恒压容器,平衡时容器中n(Cl2)________(填“>”、“=”或“<”)1.6mol。
⑤温度为T2时,该反应的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.对于有气体参加的反应,增大压强,反应速率加快,是因为活化分子百分数增加
B.设NA为阿伏加德罗常数的值,500mL1mol/L氯化铁溶液中Fe3+的数目等于0.5NA
C.常温下将干燥的pH试纸浸泡在0.01mol/L的NaOH溶液中来测溶液的pH,测得pH=12
D.要判断反应进行方向,须综合考虑体系的焓变和熵变,焓减且熵增的反应为自发反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AlH3。下列说法正确的是( )
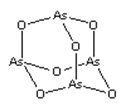
A.As2O3 分子中As原子的杂化方式为sp2
B.LiAlH4为共价化合物
C.AsCl3空间构型为平面正三角形
D.AlH3分子键角大于109.5°
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com