
| A. | 白炽灯工作时,电能全部转化为光能 | |
| B. | 风力发电时,风能主要转化为电能 | |
| C. | 煤燃烧时,化学能主要转化热能 | |
| D. | 电解水生成H2和O2时,电能主要转化为化学能 |
科目:高中化学 来源: 题型:解答题
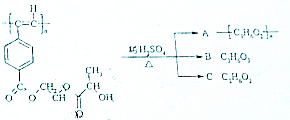 聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,如图是聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解示意图:
聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,如图是聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解示意图: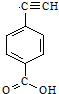 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀碱液的pH值,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时仰视刻度线,所配溶液浓度偏大 | |
| C. | 用盐酸标准溶液滴定未知浓度的NaOH溶液时,若滴定前滴定管内无气泡,终点读数时有气泡,则所测NaOH溶液的浓度偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.30 | B. | 0.35 | C. | 0.40 | D. | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
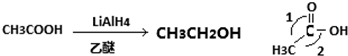
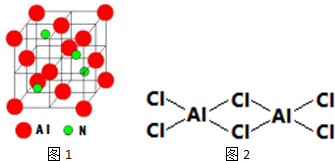
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 89.6 mL | B. | 112 mL | C. | 168 mL | D. | 224 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
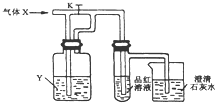
| A. | X是SO2,Y是饱和NaHCO3 溶液 | B. | X是H2S,Y是浓H2SO4 | ||
| C. | X是CO2,Y是Na2SO3 溶液 | D. | X是Cl2,Y是Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Al能放出H2的溶液中:K+、Na+、CO32-、NO3- | |
| B. | 滴入甲基橙变黄的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| C. | 能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br- | |
| D. | 水电离出的c(H+)=1×10-12 mol•L-1的溶液中:Na+、Mg2+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com