
分析 (1)验证碳酸、醋酸、硅酸的酸性强弱,将CH3COOH与Na2CO3发生反应:Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑,说明酸性CH3COOH>H2CO3;产生的CO2气体先通过饱和的碳酸氢钠溶液除去混有的醋酸蒸汽,然后再通入硅酸钠溶液发生反应CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓,说明酸性H2CO3>H2SiO3,再结合仪器的作用画图;
(2)根据操作步骤排序,再根据物质间的反应及物质的性质确定实验现象及结论.
解答 解:(1)验证碳酸、醋酸、硅酸的酸性强弱,将CH3COOH与Na2CO3发生反应:Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑,说明酸性CH3COOH>H2CO3;产生的CO2气体先通过饱和的碳酸氢钠溶液除去混有的醋酸蒸汽,然后再通入硅酸钠溶液发生反应CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓,说明酸性H2CO3>H2SiO3;D中为醋酸,A为碳酸钠,醋酸滴加到A中与Na2CO3反应生成二氧化碳,B中为饱和碳酸氢钠溶液,除去二氧化碳中混有的醋酸蒸汽,二氧化碳与通入C中与硅酸钠反应生成硅酸,所以简易的装置图见答案,
答:简易的装置图为 ;
;
(2)实验时,实验操作步骤为:连接装置、检查气密性、加入药品和试剂、打开分液漏斗的盖子并打开活塞,醋酸和碳酸钠反应Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑,A中固体表面有气泡产生,说明酸性CH3COOH>H2CO3;乙酸易挥发,产生的CO2气体先通过饱和的碳酸氢钠溶液除去混有的醋酸蒸汽,然后再通入试管C硅酸钠溶液发生反应CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓,反应生成碳酸钠和硅酸沉淀,所以看到有沉淀生成,说明酸性H2CO3>H2SiO3,酸性CH3COOH>H2CO3>H2SiO3,
答:A中固体表面有气泡产生;说明酸性CH3COOH>H2CO3;试管C中有白色沉淀生成;说明酸性H2CO3>H2SiO3;酸性CH3COOH>H2CO3>H2SiO3.
点评 本题考查了探究顺序强弱实验方案的设计,明确物质的性质是解本题关键,结合强酸制取弱酸实验原理来分析解答,注意:醋酸有挥发性,导致制取的二氧化碳中含有醋酸,干扰实验,为易错点,题目难度中等.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照条件下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下浓硫酸、浓硝酸可以用铝罐储存,说明浓硫酸、浓硝酸与铝不反应 | |
| D. | 反应CuSO4+H2S═CuS↓+H2SO4说明硫化铜既不溶于水,也不溶于稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )
甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )| A. | 分子式为C25H20 | |
| B. | 所有的碳原子不可能都在同一平面上 | |
| C. | 所有原子一定在同一平面上 | |
| D. | 此物质属于芳香烃类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L Cl2溶于水,转移的电子数目小于 NA | |
| B. | 常温常压下,18 g H2O中含有的原子总数为3 NA | |
| C. | 0.1 moI•L-1的CH3COOH溶液中所含的离子和分子总数为0.1NA | |
| D. | 乙烯和聚乙烯组成的14 g混合物中原子总数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
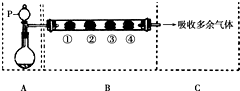 用如图装置可以完成一系列实验(图中夹持装置已略去).请回答下列问题:
用如图装置可以完成一系列实验(图中夹持装置已略去).请回答下列问题:| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘 水混合液 | 氢硫酸 |
| 现象 | a | b | 褪色 | 浅黄色 |
| 体现SO2的性质 | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com