某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.
已知该反应中H2O2只发生如下过程:H2O2-→O2.
(1)该反应中的还原剂是 .
(2)该反应中,发生还原反应的过程是 -→ .
(3)写出该反应的化学方程式,并用单线桥法标出电子转移的方向和数目 .
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 .
【答案】
分析:(1)由H
2O
2只发生如下过程H
2O
2-→O
2可知,利用该过程中O元素的化合价由-1价升高到0来分析;
(2)氧化剂发生还原反应,利用元素的化合价降低来分析;
(3)由失去电子的元素指向得到电子的元素,并标出电子转移的总数来用单线桥法标出电子转移的方向和数目;
(4)由反应可知生成3mol气体转移6mol电子,以此来计算.
解答:解:(1)由信息H
2O
2-→O
2中可知,O元素的化合价由-1价升高到0,则H
2O
2为还原剂,故答案为:H
2O
2;
(2)氧化剂发生还原反应,含元素化合价降低的物质为氧化剂,则Cr元素的化合价降低,即还原反应的过程为H
2CrO
4→Cr(OH)
3,故答案为:H
2CrO
4;Cr(OH)
3;
(3)该反应中O元素失电子,Cr元素得到电子,2molH
2CrO
4反应转移电子为2mol×(6-3)=6mol,则用单线桥法标出电子转移的方向和数目为
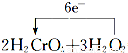
=2Cr(OH)
3+3O
2↑+2H
2O,故答案为:
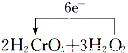
=2Cr(OH)
3+3O
2↑+2H
2O;
(4)由2H
2CrO
4+3H
2O
2═2Cr(OH)
3+3O
2↑+2H
2O可知,生成3mol气体转移6mol电子,则转移了0.3mol电子,则产生的气体的物质的量为
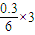
mol=0.15mol,
其在标准状况下体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36.
点评:本题考查氧化还原反应,明确过氧化氢发生的反应及氧化还原反应中既有元素的化合价升高又有元素的化合价降低来分析是解答的关键,然后利用化合价变化来计算电子的转移即可.

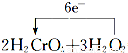 =2Cr(OH)3+3O2↑+2H2O,故答案为:
=2Cr(OH)3+3O2↑+2H2O,故答案为: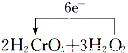 =2Cr(OH)3+3O2↑+2H2O;
=2Cr(OH)3+3O2↑+2H2O;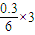 mol=0.15mol,
mol=0.15mol,

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案

 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O