
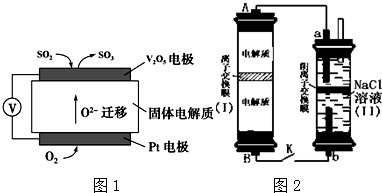
分析 (1)①原电池中阴离子移向负极;
②在V2O5电极上,SO2失电子发生氧化反应生成SO3;
(2)①原电池的负极发生氧化反应;
②氯气与氢氧化钠反应生成次氯酸钠和氯化钠;
③a极生成氯气,b极生成氢气,当有0.04mol Na+通过离子交换膜时,有0.04mol氢离子放电;
(3)①根据元素守恒知,生成物中还含有H2O,该反应是在酸性条件下进行的反应,所以反应物中还含有氢离子,该反应中V元素化合价由+5价变为+4价,草酸中C元素化合价由+3价变为+4价,根据转移电子守恒、原子守恒配平方程式;
②生成的气体是二氧化碳,根据二氧化碳和转移电子之间的关系式计算转移电子数目.
解答 解:(1)①原电池中阴离子移向负极,故答案为:负;
②在V2O5电极上,SO2失电子发生氧化反应生成SO3,电极方程式为:SO2-2e-+O2-=SO3,
故答案为:SO2-2e-+O2-=SO3;
(2)①原电池的负极发生氧化反应,所含元素化合价升高,所以负极区电解质为:Na2S2、Na2S4,
故答案为:Na2S2、Na2S4;
②氯气与氢氧化钠反应生成次氯酸钠和氯化钠,则离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
③a极生成氯气,b极生成氢气,当有0.04mol Na+通过离子交换膜时,有0.04mol氢离子放电,生成氢气0.02mol,标准状况下体积为:0.02mol×22.4L/mol=0.448L=448mL,故答案为:448;
(3)①根据元素守恒知,生成物中还含有H2O,该反应是在酸性条件下进行的反应,所以反应物中还含有氢离子,该反应中V元素化合价由+5价变为+4价,草酸中C元素化合价由+3价变为+4价,其转移电子总数为2,所以VO2+的计量数是2、H2C2O4的计量数是1,根据转移电子守恒、原子守恒配平方程式为2VO2++H2C2O4+2H+=2VO2++2CO2↑+2H2O,故答案为:2;1;2H+;2;2;2H2O;
②生成的气体是二氧化碳,设转移电子数为x
2VO2++H2C2O4+2H+=2VO2++2CO2↑+2H2O 转移电子数
44.8L 2NA
11.2L x
44.8L:2NA:11.2L:x
x=$\frac{2{N}_{A}×11.2L}{44.8L}$=0.5NA,故答案为:0.5NA.
点评 本题考查氧化还原反应配平、根据方程式计算等知识点,侧重考查分析问题能力、计算能力,熟悉元素化合价是解本题关键,注意有机物中C元素化合价判断方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | 肥皂 | C. | C17H35COONa | D. | 高级脂肪酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 漂白粉和二氧化硫均具有漂白性,将两者混合使用,可增强漂白效果 | |
| C. | 酒精能使蛋白质变性,医院一般用100%的酒精进行消毒 | |
| D. | 氧化铝熔点很高,其制造的坩埚可用于熔融烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | CO2过度排放会导致温室效应 | |
| B. | 植物的光合作用有利于维持大气中O2和 CO2平衡 | |
| C. | 煤和石油的主要成分是有机物 | |
| D. | 碳循环过程中,碳元素均被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1 L0.1mol•L-1的硝酸铵溶液中氮原子数目为0.2NA | |
| B. | 标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA | |
| C. | 1 mol有机物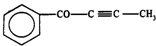 中最多有6 NA个原子在一条直线上 中最多有6 NA个原子在一条直线上 | |
| D. | 1 mol甲基(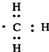 )所含的电子数为7 NA )所含的电子数为7 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
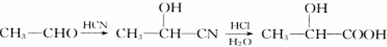

 .
.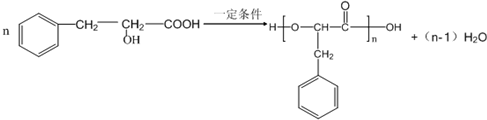 .
.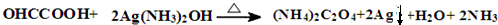 .
.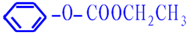
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com