
【题目】人类认识原子结构经历了几个阶段,其中卢瑟福提出的是( )
A. 古典原子论 B. 近代原子论 C. 葡萄干面包模型 D. 原子结构的模型
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】按要求填空
(1)已知实验室制备氧气可以通过加热高锰酸钾实现,其发生的反应如下:2KMnO4 ![]() K2MnO4+MnO2+O2↑其中被氧化的元素是 , 还原产物是 .
K2MnO4+MnO2+O2↑其中被氧化的元素是 , 还原产物是 .
(2)查阅资料可知:铜和浓H2SO4共热,发生如下反应:Cu+2H2SO4 ![]() CuSO4+SO2↑+2H2O该反应中氧化剂与还原剂的物质的量之比为 , 其中H2SO4在反应中体现性.
CuSO4+SO2↑+2H2O该反应中氧化剂与还原剂的物质的量之比为 , 其中H2SO4在反应中体现性.
(3)在一定条件下,RO3n﹣和氟气可发生如下反应:RO3n﹣+F2+2OH﹣=RO4﹣+2F﹣+H2O从而可知在RO3n﹣中元素R的化合价是 .
(4)请用双线桥表示下列反应方程式中转移的电子数目及方向:
K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O
若反应中,发生氧化反应的HCl为1.2mol,则被还原的K2Cr2O7物质的量为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCl2、KCl、K2SO43种盐配成混合液后,若溶液中n(K+)=1.5 mol、n(Mg2+)=0.5 mol、n(Cl-)=1.5 mol,则溶液中n(SO42-)应为
A. 0.5 molB. 0.25 mol
C. 0.15 molD. 1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得:(已知H2C2O4中的碳为+3价)2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。试回答下列问题。
(1)该反应中氧化产物的化学式是___________;被还原的元素是___________。
(2)用双线桥标出上述反应的电子转移情况______。
2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
(3)若反应共产生了4.48L气体(标准状况),则反应转移电子的物质的量为_________mol,消耗还原剂的物质的量为___________mol。
(4)标准状况下44.8mL的ClO2气体恰好能与50mL 0.1mol·L-1的Na2SO3溶液液完全反应,生成Na2SO4,氯元素在产物中的化合价为___________;此过程说明ClO2具有____(填“氧化”或“还原”)性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质均属于分子晶体且均为化合物的是( )
A.NH3、HD、C10H8B.PCl3、CO2、AlCl3
C.SO2、SiO2、P2O5D.CCl4、H2O2、Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL一定物质的量浓度的盐酸中滴加一定物质的量浓度的NaOH溶液,其pH变化如图所示,则两溶液的物质的量浓度分别是( )
A | B | C | D | |
盐酸的物质的量浓度 | 0.12 | 0.04 | 0.03 | 0.09 |
NaOH的物质的量浓度 | 0.04 | 0.12 | 0.09 | 0.03 |
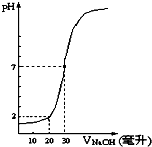
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr====2KCl+Br2,②KClO3+6HCl(浓)====3Cl2↑+KCl+3H2O,③2KBrO3+Cl2====Br2+2KClO3,下列说法正确的是 ( )
A. 上述3个反应都是置换反应
B. 氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
C. 反应②中若得到6.72 L Cl2(标准状况),则电子转移个数为3.01×1023
D. ③中1 mol氧化剂参加反应得到电子的物质的量为2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图中①、②、③、④表示不同化学元素所组成的化合物,乙图表示由四个单体构成的化合物。以下说法错误的是

A. 若甲图中的②是良好的储能物质,则②是脂肪
B. 若甲图中④能吸收、传递和转换光能,则④可用无水乙醇提取
C. 若①是乙图中的单体,则乙表示的化合物为多(或四)肽
D. 若③是脱氧核苷酸,则由③组成的乙彻底水解后的产物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一无色透明的水溶液中能大量共存的离子组是
A.Ba2+、SO42-、K+B.NH4+、Na+、OH-
C.Cu2+、C1-、NO3-D.Na+、C1-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com