
 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:分析 (1)2p轨道有3个电子,电子排布同一能级不同轨道时,基态原子的电子总是优先单独占据一个轨道,且自旋方向相同;
前4周期元素中,基态原子核外电子排布成单电子数最多,结合洪特规则特例,元素的价层电子排布式为3d54s1;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p轨道为半满稳定状态,第一电离能高于同周期相邻元素的;
(3)根据8电子结构,N2F2分子的结构式为F-N=N-F;
(4)F元素电负性比H大,NF3中N周围电子密度小于NH3中N周围电子密度;
(5)NH4BF4中NH4+、BF4-均含有1个配位键;
(6)①利用周期表中元素位置左右移动(注意电荷变化)或同主族替换法书写;
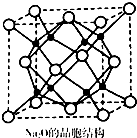
②晶胞中白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球数目为8,故白色球为O原子,黑色球为Na原子,钠原子配位数为4,而原子配位数与原子数目成反比;表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:(1)2p轨道有3个电子,电子排布同一能级不同轨道时,基态原子的电子总是优先单独占据一个轨道,且自旋方向相同,遵循洪特规则,
前4周期元素中,基态原子核外电子排布成单电子数最多,结合洪特规则特例,可知元素的价层电子排布式为3d54s1,
故答案为:洪特规则;3d54s1;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p轨道为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C,
故答案为:N>O>C;
(3)根据8电子结构,N2F2分子的结构式为F-N=N-F,N原子的杂化轨道数目为2+1=3,N原子杂化方式是sp2杂化,单键为σ键,双键含有1个σ键、1个π键,l mol N2F2含有3molσ键,
故答案为:sp2杂化;3;
(4)F元素电负性比H大,NF3中N周围电子密度小于NH3中N周围电子密度,NF3的键角<NH3的键角,
故答案为:<;F元素电负性比H大,NF3中N周围电子密度小于NH3中N周围电子密度;
(5)NH4BF4中NH4+、BF4-均含有1个配位键,l mol NH4BF4 含有2mol配位键,
故答案为:2;
(6)①原子总数相同,价电子总数相同的微粒互为等电子体,与N3-互为等电子体的分子或离子为:CO2、N2O、CNS-、NO2+、CNO-等,
故答案为:CO2、N2O、CNS-、NO2+、CNO-等;
②晶胞中白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球数目为8,故白色球为O原子,黑色球为Na原子,钠原子配位数为4,而原子配位数与原子数目成反比,故O原子配位数为4×2=8,
晶胞质量为4×$\frac{62}{6.02×1{0}^{23}}$g,则晶体密度=4×$\frac{62}{6.02×1{0}^{23}}$g÷(566×10-10 cm)3=$\frac{4×62}{6.02×1{0}^{23}×(566×1{0}^{-10})^{3}}$g•cm-3,
故答案为:8;$\frac{4×62}{6.02×1{0}^{23}×(566×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式、化学键、等电子体、晶胞结构与计算等,注意了对规律中特殊性的考查,掌握均摊法进行晶胞的有关计算.


科目:高中化学 来源: 题型:选择题
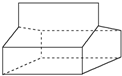
| A. | 篮烷的分子式为C12H12 | |
| B. | 篮烷分子中存在3个六元环 | |
| C. | 篮烷分子中存在3个五元环 | |
| D. | 篮烷的一氯代物共有5种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m1>m2 | B. | m1<m2 | C. | m1≥m2 | D. | m1≤m2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一周期第ⅠA族 | B. | 第二周期第VⅡA族 | C. | 第三周期第VⅡA族 | D. | 第三周期第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04mol•L-1 | B. | 0.04mol•L-1•s-1 | C. | 0.08mol•L-1 | D. | 0.08mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
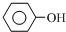 +3Br2→
+3Br2→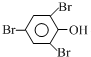 ↓+3HBr
↓+3HBr查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com