

| A. | 锌片为正极 | |
| B. | 该电池工作时电能转化为化学能 | |
| C. | 该电池的总反应为Zn+2H+═Zn2++H2↑ | |
| D. | 电子由铜片通过导线流向锌片 |
科目:高中化学 来源: 题型:解答题

 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$
 b.
b. c.
c.
 .
. .
. .
. ,写出其合成路线:
,写出其合成路线: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 用途 |
| A | 糖类、油脂和蛋白质均能水解 | 供给人类营养 |
| B | 铁能被浓硫酸钝化 | 铁制器皿用作铜和浓硫酸的反应容器 |
| C | 碳单质的还原性强于硅单质 | 碳与石英反应冶炼粗硅 |
| D | 常温下,氨气能与氯气反应 | 浓氨水检验氯气管道泄漏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英坩埚耐高温,可用来加热熔化NaOH固体 | |
| B. | 二氧化硫具有强氧化性,可用于漂白纸张 | |
| C. | 铝能置换出氧化铁中的铁,工业上利用铝热反应冶炼铁 | |
| D. | 医用酒精能使蛋白质变性,可用来消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
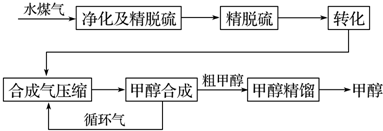
| 物质 | H2 | CO | CH3OH |
| 浓度/mol•L-1 | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为3的He原子:32He | B. | HCl的电子式: | ||
| C. | S2-的结构示意图: | D. | 肼(N2H4)的结构简式:H2N-NH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | FeS固体放入稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ | |
| C. | 碳酸氢镁和足量的氢氧化钙溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使Al3+沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2 Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
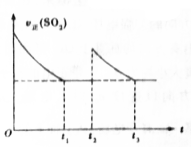 一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.测得v正(SO2)随反应时间(t)的变化如图所示.下列有关说法正确的是( )
一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.测得v正(SO2)随反应时间(t)的变化如图所示.下列有关说法正确的是( )| A. | t2时改变的条件是:只加入一定量的SO2 | |
| B. | t1时平衡常数K1大于t3时平衡常数K2 | |
| C. | t1时平衡混合气的$\overline{{M}_{1}}$大于t3时平衡混合气的$\overline{{M}_{2}}$ | |
| D. | t1时平衡混合气中的SO3的体积分数等于t3时平衡混合气中SO3的体积分数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com