
分析 (1)含有弱离子的盐,浓度越大其水解程度越小;
(2)多元弱酸根离子第一步水解程度远远大于第二步水解程度;
(3)温度越高,越促进弱离子水解;
(4)0.1mol/L H2SO4溶液中氢离子浓度为0.2mol/L,0.1mol/L HCl溶液中氢离子浓度为0.1mol/L.
解答 解:(1)含有弱离子的盐,浓度越大其水解程度越小,但浓度大的溶液中离子水解的个数多,所以浓度越大的氯化铵溶液的pH越小,则pH:0.1mol•L-1 NH4Cl溶液<0.01mol•L-1 NH4Cl溶液,故答案为:<;
(2)多元弱酸根离子第一步水解程度远远大于第二步水解程度,所以碳酸根离子水解程度大于碳酸氢根离子,则溶液的pH0.1mol•L-1 Na2CO3溶液>0.1mol•L-1 NaHCO3溶液,故答案为:>;
(3)温度越高,越促进弱离子水解,温度越高氯化铁的水解程度越大,其溶液的pH越小,所以pH25℃1mol•L-1FeCl3溶液>80℃1mol•L-1FeCl3溶液,故答案为:>;
(4)0.1mol/L H2SO4溶液中氢离子浓度为0.2mol/L,0.1mol/L HCl溶液中氢离子浓度为0.1mol/L,溶液PH0.1mol/L H2SO4溶液<0.1mol/L HCl溶液,
故答案为:<.
点评 本题考查了pH大小的比较,涉及盐类水解的影响因素等知识点,知道盐类水解程度与温度、溶液浓度的关系是解本题关键,注意(1)中虽然浓度越小弱离子水解程度越大,但浓度越小弱离子水解个数越少,为易错点,题目难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶质的质量分数w=$\frac{1000a}{17V}$100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ (mol/L) | |
| C. | 溶液中c(OH-)=$\frac{b}{V}$ (mol/L) | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
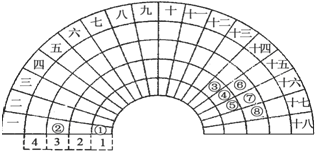
| A. | ③元素形成的单质晶体均属于原子晶体 | |
| B. | ④元素的气态氢化物易液化,是因为其分子间存在氢键 | |
| C. | ②、⑦、⑧对应的简单离子半径依次减小 | |
| D. | ②⑤⑦三种元素形成的盐溶液在25℃时的pH值为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中可能大量存在Fe2+、Cl?、NO3?、Na+ | |
| B. | 无色溶液中可能大量存在Mg2+、NH4+、Cl?、SO42- | |
| C. | 强碱性溶液中可能大量存在NH4+、K+、Cl?、SO42? | |
| D. | 酸性溶液中可能大量存在Fe3+、K+、I?、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
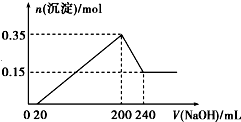
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用盐酸滴定氢氧化钠溶液时向锥形瓶中量取25.00mL的氢氧化钠溶液 | |
| B. | 用量筒测得排水法收集制得的氢气体积为50.28 mL | |
| C. | 用两只250 mL的容量瓶配制0.1 mol•L-1 500 mL的NaOH溶液 | |
| D. | 用托盘天平称取2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
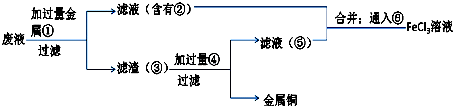
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 充电过程是电能转化为化学能的过程 | |
| C. | 放电时负极附近溶液的碱性不变 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com