
| A. | 依据其结构判断该含氧酸为强酸 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线形非极性分子 | D. | 该分子的电子式是H:O:Cl |
分析 A.强酸是完全电离的酸,依据其结构不能判断该含氧酸为强酸;
B.单键含有一个σ键;
C.不同非金属元素之间形成极性键,分子结构不对称,正负电荷的中心不重合的分子为极性分子,而结构对称且正负电荷的中心重合的分子为非极性分子;
D.次氯酸分子为共价化合物,其中氢原子最外层达到2个电子稳定结构,氯、氧原子达到8电子稳定结构.
解答 解:A.判断酸是否为强酸,关键看其在水溶液中是否完全电离,不能依据其结构判断,次氯酸为含氧酸,但为弱酸,故A错误;
B.单键含有一个σ键,其结构为H-O-Cl,所以O原子与H、Cl都形成σ键,故B正确;
C.H-O-Cl中含有极性键,结构不对称,属于极性分子,故C错误;
D.H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,次氯酸为共价化合物,其电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了次氯酸分子的结构,明确强酸的概念、中心原子杂化类型的判断、分子极性的判断、电子式的书写方法是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液不变浑浊.先通入CO2再通入氨气,溶液变浑浊 | CaCl2溶液 |
| B | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| C | 通 CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| D | 通 CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
| 难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.1 g | B. | 27.2 g | C. | 30 g | D. | 14.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中加CaCO3后,溶液漂白性增强 | |
| B. | 盛有NO2、N2O4混合气体的烧瓶置于冰水中,气体颜色变浅 | |
| C. | 反应:H2(g)+I2(g)?2HI(g) 达平衡后,减小气体体积,气体颜色变深 | |
| D. | 恒温等容时,在SO2,O2和SO3的平衡体系中加入氧气,提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.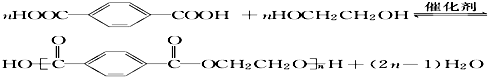 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com