
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
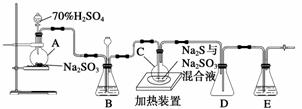
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq)(Ⅰ)2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)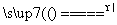 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若__________________________________________________,则整个装置气密性良好。装置D的作用是________________________________________________________________________。
装置E中为______________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为____________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是______________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:___________________________________________________
________________________________________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O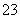 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铝合金3 g与100 mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4 g,则原硫酸溶液的物质的量浓度为( )
A.1.5 mol·L-1 B.1 mol·L-1
C.2.5 mol·L-1 D.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是( )
A.c(CO32—)>c(H2CO3)
B.c(Na+)>c(HCO3—)>c(OH—)>c(H+)
C.c(Na+)+c(H+)=c(HCO3—)+c(CO32—)+c(OH—)
D.c(Na+)=c(HCO3—)+c(CO32—)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度前者比后者大
B.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3
C.BaSO4(s)+4C(s)===BaS(s)+4CO(g)室温下不能自发进行,说明该反应的ΔH﹤0
D. 为准确测定盐酸与氢氧化钠溶液反应的中和热,所用酸和碱的物质的量应相等
为准确测定盐酸与氢氧化钠溶液反应的中和热,所用酸和碱的物质的量应相等
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO·Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
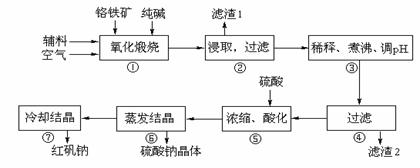
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3 Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3 2NaAlO2+CO
2NaAlO2+CO 2↑
2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
⑴“①”中反应是在回转窑中进行 ,反应时需不断搅拌,其作用是
,反应时需不断搅拌,其作用是
⑵ “③”中调节pH至4.7,目的是 。
⑶ “⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: 。
( 4)称取重铬酸钠试样2.5000 g配成250 mL溶液,取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放
4)称取重铬酸钠试样2.5000 g配成250 mL溶液,取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放 于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是:____________________________________;
②若实验中共用去Na2S2O3标准溶液40.00 mL,所得产品的中重铬酸钠的纯度(设整个过程中其它杂质不参与反应)__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2、NO2、O2 乙:MgO、NO2、O2 丙:Mg3N2、O2 丁:MgO、NO2、N2
实验前,小组成员经讨论认定猜想丁不成立,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。 请回答:

查看答案和解析>>
科目:高中化学 来源: 题型:
下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是 ( )
A.Na+、Ba2+、Cl、SO42- B. Ca2+、HCO3、C1、K+
C.MnO4、K+、I、H+ D. H+ 、Cl 、Na+ 、CO32
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com