
分析 根据硅酸钠的化学式Na2SiO3和化合物中正负化合价的代数和为0的原则计算硅元素的化合价;
根据反应物是氢氧化钠和二氧化硅、生成物是硅酸钠和水书写要求的化学方程式;
根据质量守恒定律,以及氢氧化钠会与空气中的二氧化碳反应生成碳酸钠而变质;
在实验室常在样品中加盐酸,将生成的气体通入澄清石灰水中,看是否出现沉淀来检验碳酸盐;
瓶口的白色固体可能是氢氧化钠溶液中的水分蒸发留下的氢氧化钠,也可能是变质生成的碳酸钠,然后对白色固体探究.
解答 解:根据化合物中化合价代数和为0的原则,设硅的化合价为x,硅酸钠Na2SiO3中(+1)×2+x+(-2)×3=0,解得x=+4,
反应物是氢氧化钠和二氧化硅,生成物是硅酸钠和水,反应的方程式为SiO2+2NaOH═Na2SiO3+H2O,氢氧化钠会和空气中的二氧化碳等气体接触,生成的白色固体可能是碳酸钠,在实验室检验碳酸根离子,可在样品中加盐酸,有气泡产生,然后将产生的气体通入澄清石灰水中,石灰水变浑浊,如为氢氧化钠,与盐酸反应不生成气体,
故答案为:+4;SiO2+2NaOH═Na2SiO3+H2O;空气中含有二氧化碳,氢氧化钠能与二氧化碳反应生成碳酸钠;
实验方案:取少量白色固体放入试管中,滴入稀盐酸,再将产生的气体通入澄清的石灰水中;
猜想:白色固体是氢氧化钠;
实验方案:取少量白色固体放入试管中,滴入足量的稀盐酸,不产生气泡.
点评 本题综合考查元素化合物知识,侧重考查物质的性质检验和实验设计,为高频考点,注意把握物质的性质以及实验设计的原理,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,一定有化学键的断裂和形成 | |
| B. | 日常生活中的废旧电池会污染环境,所以应集中填埋处理 | |
| C. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| D. | 放热反应的反应速率,一定比吸热反应的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
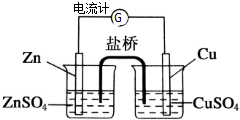 为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:
为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| B. | 50mL18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 78g Na2O2晶体中含有的离子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | B. | BaCl2 Na2SO4 (NH4)SO4 KOH | ||
| C. | AgNO3 NaCl KCl CuCl2 | D. | Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加甲基橙试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- | |
| B. | 水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ | |
| C. | pH值为1的溶液 Cu2+、Na+、Mg2+、NO3- | |
| D. | 所含溶质为Na2SO4的溶液 K+、HCO3-、NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 | |
| B. | 0.5mol Na2SO4中含Na+数目为6.02×1023个 | |
| C. | 标准状况下,1molH2O体积约为22.4L | |
| D. | 1molO2的质量为32g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com