
 用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.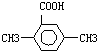 .
. 分析 (1)根据盖斯定律及题干中热化学方程式计算,①×4+②+③×2可得,得到反应2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的△H;
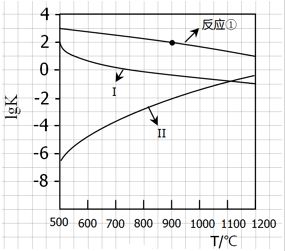
(2)根据反应①-③的平衡常数的对数lgK随反应温度T的变化曲线进行判断变化规律;
(3)根据图象判断900℃时反应①的lgK=2,则平衡常数为102,设出反应前CO浓度为c,根据平衡常数表达式列式计算即可;
(4)根据氧气能够消耗副产物中生成的二氧化硫、碳进行分析;
(5)根据“CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4”可知另一种反应物为氧气,据此写出反应的化学方程式;在对二甲苯的苯环上添上应该羧基即可得到该有机物.
解答 解:(1)根据盖斯定律,①×4+②+③×2可得:2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的△H=4△H1+△H2+2△H3,
故答案为:4△H1+△H2+2△H3;
(2)根据图象曲线变化可知,反应①、③为放热反应,随着温度的升高,平衡常数K逐渐减小,则lgK逐渐减小,而反应②为吸热反应,升高温度,平衡常数K逐渐增大,则lgK逐渐增大,所以Ⅰ表示的为反应③、Ⅱ曲线表示的为反应②,变化规律为:当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;根据反应①和曲线Ⅰ(反应③反应)的反应热可知,当温度同等变化时,△H的数值越大lgK的变化越大,
故答案为:(a)当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;(b)当温度同等变化时,△H的数值越大lgK的变化越大;
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应方程式为:$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△H1=-47.3kJ•mol-1,根据图象曲线可知,反应①于900℃时lgK=2,平衡常数为102=100,c平衡(CO)=8.0×10-5 mol•L-1,设一氧化碳反应前浓度为c,则反应消耗的CO浓度=反应生成二氧化碳浓度=(c-8.0×10-5)mol/L,平衡常数K=$\frac{[C{O}_{2}]}{[CO]}$=$\frac{c-8.0×1{0}^{-5}}{8×1{0}^{-5}}$=100,解得c=8.08×10-3mol/L,一氧化碳的转化率为:$\frac{8.0×1{0}^{-3}}{8.08×1{0}^{-3}}$×100%≈99%,
答:CO的转化率为99%;
(4)氧气能够与二氧化硫、C发生反应,所以在初始原料中加入适量的氧气,可以抑制副反应②③的进行,有利于获得更纯净的CO2,
故答案为:O2;
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,则另一种反应为为氧气,该反应的化学方程式为 CaS+2O2$\frac{\underline{\;高温\;}}{\;}$CaSO4;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,相当于用羧基取代苯环上的氢原子,对二甲苯中苯环上4个H原子位置等价,则该产物的结构简式为: ,
,
故答案为:CaS+2O2$\frac{\underline{\;高温\;}}{\;}$CaSO4; .
.
点评 本题考查了化学平衡常数的计算、有机物结构与性质、热化学方程式的书写等知识,题目难度中等,试题题量较大,注意掌握化学平衡常数的概念及计算方法,明确热化学方程式的书写方法及盖斯定律的含义及应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应一定不需加热就可以进行 | |
| B. | 等物质的量的氢气完全燃烧生成气态水比生成液态水放热多 | |
| C. | 中和热测定时,用铁质材料代替环形玻璃搅拌器,所测中和热数值偏小 | |
| D. | S(g)+O2(g)═SO2 (g);△H1 S(s)+O2(g)═SO2 (g);△H2 △H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/LNH3.H2O溶液与0.1mol/L盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合后呈酸性:c(CH3COOH)>c(CH3COO-) | |
| C. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c (Na+)=c (SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1mol/L Na2CO3溶液与0.1mol/LNaHSO4溶液等体积混合所得溶液:c(CO32-)+2 c(OH-)═c(HCO3-)+c(H2CO3)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖可通过酒化酶水解生成酒精 | |
| B. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| C. | 向植物油中加入酸性高锰酸钾紫色溶液,振荡后,酸性高锰酸钾溶液颜色褪去 | |
| D. | 淀粉溶液与稀硫酸溶液共热,再加入新制氢氧化铜悬浊液加热,无红色沉淀,则可证明淀粉没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始温度T1/℃ | 终止温度T2/℃ | 温度差(T2-T1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98g | |
| B. | 标况下,H2的摩尔体积是22.4L | |
| C. | 将1mol NaCl溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L | |
| D. | 氧气的摩尔质量与它的相对分子质量在数值上相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com