
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断正确的是( )
A.升高温度,该反应的平衡常数减小
B.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
C.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D.第二阶段,Ni(CO)4分解率较低
【答案】AC
【解析】
A. 由已知信息:第二阶段是将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍,可知升高温度,该反应向逆反应方向移动,则该反应的平衡常数减小,故A正确;
B. 可逆反应达到平衡状态时,一定满足正逆反应速率相等,在用不同物质的反应速率表示平衡状态时,必须表明“一正一逆”,且等于系数之比,因此该反应达到平衡时,4v生成[Ni(CO)4]=v生成(CO),故B错误;
C. 第一阶段要制得气态Ni(CO)4,而Ni(CO)4的沸点为42.2℃,因此应选50℃,大于沸点,便于分离出气态Ni(CO)4,故C正确;
D. 第二阶段,加热至230℃,该反应Ni(s)+4CO(g)![]() Ni(CO)4(g)的平衡常数K=2×10-5,正反应进行的程度低,则逆反应进行的程度大,说明Ni(CO)4分解率较高,可制得高纯度镍,故D错误;
Ni(CO)4(g)的平衡常数K=2×10-5,正反应进行的程度低,则逆反应进行的程度大,说明Ni(CO)4分解率较高,可制得高纯度镍,故D错误;
故选AC。


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
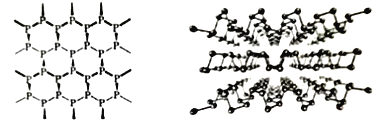
(1)黑磷是新型材料,具有类似石墨一样的片层结构(如图),层与层之间以_____结合。从结构上可以看出单层磷烯并非平面结构,但其导电性却优于石墨烯的原因是________________。
(2)四(三苯基膦)钯分子结构如下图:
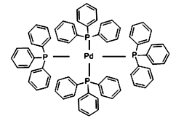
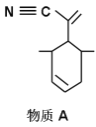
该物质可用于上图所示物质A的合成:物质A中碳原子杂化轨道类型为__________;
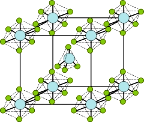
(3)PCl5是一种白色晶体,熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子.(该晶体的晶胞如图所示).熔体中P-Cl的键长只有198 nm和206 nm两种,写这两种离子的化学式为______________________;正四面体形阳离子中键角_____ PCl3的键角(填> 或<或=),原因是______________________________________.
(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体混合物X可能含有NaNO2、Na2SiO3、FeCl3、KAlO2中的一种或几种物质,某同学对该固体进行了如下实验:

下列判断正确的是
A.溶液甲中一定含有NaNO2、Na2SiO3,可能含有FeCl3、KAlO2
B.原固体混合物X中一定有KAlO2
C.固体乙、固体丁一定是纯净物
D.将溶液乙和溶液丁混合一定有无色气体生成,可能有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吗啡和海洛因都是严格查禁的毒品,吗啡分子含C:71.58%、H:6.67%、N:4.91%、其余为O。已知其相对分子质量不超过300。试求:
(1)吗啡的相对分子质量__________;
(2)吗啡的化学式_______________;
已知海洛因是吗啡的二乙酸酯。试求:
(3)海洛因的相对分子质量____________;
(4)海洛因的化学式___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2molNaOH和0.1molCa(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(标准状况)时立即停止,则这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A.氯水中有下列平衡Cl2+H2 OHCl + HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)H2(g)+I2 (g),平衡体系增大压强可使颜色变深
C.反应CO+NO2CO2+NO ΔH <0,升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取降低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用Al-PMOF可快速将芥子气降解为无毒物质,其结构如图。其中X、Y、Z为短周期元素且原子序数依次增大,X、Y同主族。下列说法正确的是

A.原子半径:Z>Y>X
B.YXZ2中Y的化合价为+5
C.含氧酸酸性:Z>Y
D.同浓度氢化物水溶液酸性:Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2LCO2所含的原子数为1.5NA
B.常温下,46gNO2和N2O4的混合物中含有的氮原子数为NA
C.1L0.5mol·L-lFeCl3溶液完全转化可制得0.5NA个Fe(OH)3胶粒
D.1molNa被完全氧化生成Na2O2,失去2NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com