
| D的单质 |
| D的单质 |
| H2O |
| D的单质 |
| D的单质 |
| H2O |
| D的单质 |
| D的单质 |
| H2O |
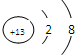 ;化合物X为Na2O2,所含化学键有离子键、共价键,
;化合物X为Na2O2,所含化学键有离子键、共价键,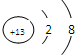 ;离子键、共价键;
;离子键、共价键;

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
| A、在1mol甲基(-CH3)中,电子总数9NA |
| B、在78g的Na2O2中,有2NA个阴离子 |
| C、标准状况下,22.4L CHC13所含有的分子数目为NA |
| D、Cu、A1为电极,浓硝酸为电解质溶液所构成的原电池中,导线上流过NA个电子,则A1电极放出气体的体积在标准状况下一定为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2和氮氧化物的排放是形成酸雨的原因 |
| B、酸雨是指PH<7的雨水 |
| C、在燃煤中加入生石灰可以减少污染 |
| D、酸雨可以毁坏森林和农田等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中Pb2+和I-浓度都增大 |
| B、溶度积常数Ksp不变 |
| C、沉淀溶解平衡不移动 |
| D、溶液中Pb2+和I-浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q与W不能形成10电子、14电子、18电子分子 |
| B、Y的最高价氧化物对应水化物的化学式只能表示为H4YO4 |
| C、Y、Z、Q分别与X化合,只能形成AB2型化合物 |
| D、X、Z、W中的两种或三种元素形成的钠盐溶液可能显酸性、碱性、中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a、b均为原电池 |
| B、c、d均为电解池 |
| C、b池中Fe极反应为Fe-2e-═Fe2+ |
| D、d池中Cu极反应为4OH--4e-═O2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com