
 ,据此完成下列问题:
,据此完成下列问题: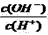 的值____________ (填:增大、不变、减小)
的值____________ (填:增大、不变、减小)  名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
为更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,AG=lg[c(H+)/c(OH-)].下列叙述中正确的是 ( )
①任何温度下,纯水的AG等于0; ②溶液的AG越小,酸性越强;
③常温下,0.1mol/L盐酸的AG=12; ④25℃时,某溶液的AG=-10,其pH=10.
A.①③ B.②④ C.①② D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
为更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,AG=lg[c(H+)/c(OH-)].下列叙述中正确的是 ( )
①任何温度下,纯水的AG等于0; ②溶液的AG越小,酸性越强;
③常温下,0.1mol/L盐酸的AG=12; ④25℃时,某溶液的AG=-10,其pH=10.
A.①③ B.②④ C.①② D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)已知25℃时部分弱电解质的电离平衡常数数据如下表:
回答下列问题:
(1)物质的量浓度均为0.1mol·L一1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO
d.NaHCO3;
pH由小到大的排列顺序是_______________________(用字母表示)
(2)常温下,0.1mol·L—1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_______________(填序号)
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH—) D.c(OH-)/c(H+)
(3)体积均为l00mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数___________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。理由是:______________________________________。
(4)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中
c(CH3COO—)—c(Na+)=_______mol·L—1(填精确值),c(CH3COO-)/c(CH3COOH)=_______。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省高三上学期期中考试理综化学试卷(解析版) 题型:选择题
常温下,0.1mol·L-1某一元酸(HA)溶液pH = 3,下列叙述正确的是( )
①该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
②用pH=3的HA溶液与pH=4的HCl溶液分别中和等浓度等体积的氢氧化钠溶液所耗去酸液的体积分别为V1和V2,其关系为10V1<V2
③pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中 c(Na+)=c(A-)+c(HA)
④0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中 2c(H+)+c(HA)=c(A-)+2c(OH-)
A .① B .②③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2009-2010学年沙河一中高二下学期化学单元测试(3) 题型:选择题
为更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,AG=lg[c(H+)/c(OH-)].下列叙述中正确的是 ( )
①任何温度下,纯水的AG等于0; ②溶液的AG越小,酸性越强;
③常温下,0.1mol/L盐酸的AG=12; ④25℃时,某溶液的AG=-10,其pH=10.
A.①③ B.②④ C.①② D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com