
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是()
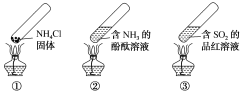
A.加热时,①中上部汇集了NH4Cl固体
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液变红,冷却后红色褪去,体现SO2的氧化性
D.三个“封管实验”中所发生的化学反应都是可逆反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大。W原子的最外层电子数是X与Z原子最外层电子数之和,W简单氢化物r溶于水完全电离。m、p是由这些元素组成的二元化合物,m可做制冷剂,无色气体p遇空气变为红棕色。下列说法正确的是( )
A.简单离子半径:W>Z>Y>X
B.Y原子的价电子轨道表示式为![]()
C.r与m可形成离子化合物,其阳离子电子式为![]()
D.一定条件下,m能与Z的单质反应生成p
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的结构,用化学用语完成下列问题。
① | |||||||||||||||||
② | ③ | ④ | |||||||||||||||
⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||||||||||||
(1)表中有编号的元素中化学性质最不活泼的,其原子结构示意图为__;④与⑤按照原子个数比1∶1形成的化合物中含有的化学键有___。
(2)①与②形成的最简单化合物的空间构型为__,将此化合物与⑧的单质混合于一干燥的集气瓶,密封后放在光亮处一段时间后,观察到的现象是__。
(3)由③形成的单质的电子式为__;⑤与⑦的最低价形成的化合物的电子式为__。
(4)⑧的最高价氧化物对应的水化物的化学式是___;①分别与④、⑦形成的简单化合物的稳定性由强到弱的顺序是__。
(5)④、⑥、⑧三种元素的原子形成的简单离子中半径由大到小的顺序是__。
(6)运用你掌握的化学理论,设计一个实验,证明⑦的非金属性比②强__(用化学方程式表示出反应原理)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁是黄色晶体,常用作照相显影剂、新型电池材料等。
实验室制备草酸亚铁并测定其中Fe2+和C2O42的物质的量之比确定其纯度,步骤如下:
Ⅰ.称取一定质量的硫酸亚铁铵[(NH4)2Fe(SO4)2]于烧杯中,加蒸馏水和稀硫酸,加热溶解,再加饱和H2C2O4溶液,加热沸腾数分钟,冷却、过滤、洗涤、晾干,得黄色晶体。
Ⅱ.称取m gⅠ中制得的晶体于锥形瓶中,加入过量稀硫酸使其溶解,70℃水浴加热,用c mol·L1 KMnO4溶液滴定至终点,消耗KMnO4溶液v1 mL(其中所含杂质与KMnO4不反应)。
Ⅲ.向Ⅱ滴定后的溶液中加入过量锌粉和稀硫酸,煮沸,至反应完全,过滤,用c mol·L1 KMnO4溶液滴定滤液至终点,消耗KMnO4溶液v2 mL。
Ⅳ.重复上述实验3次,计算。
已知:ⅰ.草酸是弱酸。
ⅱ.pH>4时,Fe2+易被O2氧化。
ⅲ.酸性条件下,KMnO4溶液的还原产物为近乎无色的Mn2+。
回答下列问题:
(1)Ⅰ中加入稀硫酸的目的是__________________________、_______________________。
(2)Ⅱ中与KMnO4溶液反应的微粒是_____________、____________。
(3)Ⅲ中加入过量锌粉仅将Fe3+完全还原为Fe2+。若未除净过量锌粉,则消耗KMnO4溶液的体积V ______v2 mL(填“>”、“=”或“<”)。
(4)Ⅲ中,滴定时反应的离子方程式是__________________________,滴定时KMnO4溶液装在__________________(玻璃仪器)中,滴定终点的现象_________________________________________。
(5)m gⅠ中制得的晶体中,Fe2+和C2O42的物质的量之比是____________________(用含v1、 v2的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的一部分如图所示,W、X、Y、Z均为短周期主族元素,X与Z的最高正价之和与W的相等。下列说法错误的是
![]()
A.原子半径:X>Y>Z>W
B.X2W2中含有离子键和共价键
C.Y的最高价氧化物对应的水化物难溶于水
D.将由X、Z的单质组成的混合物放入冷水中,Z的单质不发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
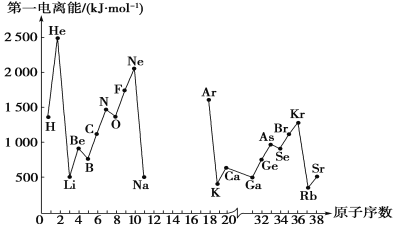
(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为____<Al<__;(填元素符号)
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是_____。
(3)上图中第一电离能最小的元素在周期表中的位置是第________周期________族;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或化学方程式中正确的有()
①向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
②向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
③将CO2气体通过过氧化钠固体:2CO2+2Na2O2=2Na2CO3+O2
④将SO2气体通过过氧化钠固体:2SO2+2Na2O2=2Na2SO3+O2
⑤氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO![]() =CaCO3↓+H2O
=CaCO3↓+H2O
⑥在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO![]() =3Fe3++2H2O+NO↑
=3Fe3++2H2O+NO↑
⑦硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-=Fe(OH)3↓
A.2项B.3项C.4项D.5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化锂(Li3N)是有机合成的催化剂,Li3N遇水剧烈反应。某小组设计实验制备氮化锂并测定其纯度,装置如图所示:
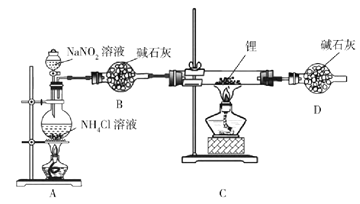
实验室用NH4Cl溶液和NaNO2溶液共热制备N2。
(1)盛装NH4Cl溶液的仪器名称是___________。
(2)安全漏斗中“安全”含义是__________。实验室将锂保存在_____(填“煤油”“石蜡油”或“水”)中。
(3)写出制备N2的化学方程式__________。
(4)D装置的作用是____________。
(5)测定Li3N产品纯度:取mg Li3N产品按如图所示装置实验。
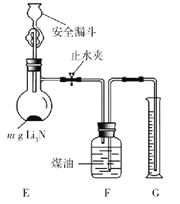
打开止水夹,向安全漏斗中加入足量水,当Li3N完全反应后,调平F和G中液面,测得NH3体积为VL(已折合成标准状况)。
①读数前调平F和G中液面的目的是使收集NH3的大气压________(填“大于”“小于”或“等于”)外界大气压。
②该Li3N产品的纯度为________%(只列出含m和V的计算式,不必计算化简)。若 Li3N产品混有Li,则测得纯度_____________(选填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于①放热反应 ②吸热反应
A:分解反应 B:化合反应C:置换反应
(1)氯酸钾分解制氧气,既是_______(填①或②)又是______。(填A或B或C,下同)
(2)生石灰跟水反应生成熟石灰,既是_______又是______。
(3)锌粒与稀硫酸的反应,既是_______又是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com