
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开啤酒盖,立即有气体逸出 | |
| B. | 新制的氯水在光照条件下颜色变浅 | |
| C. | NO2和N2O4的混合体系,压缩容器体积,颜色变深 | |
| D. | 工业生产硫酸的过程中使用过量的O2,以提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
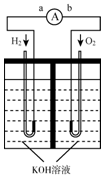 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题:
某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 电极a和电极c都发生氧化反应 | |
| B. | 电极d的电极反应式为2H++2e-=H2↑ | |
| C. | 装置X中通入SO2的速率为2.24L•min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为1.16L•min-1 | |
| D. | 装置X中每消耗64g SO2,理论上装置X和装置Y中均有1mol H+通过质子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英只能用于生产玻璃 | |
| B. | 从海水提取物质不一定要通过化学反应才能实现 | |
| C. | 二氧化硅能与氢氧化钠溶液反应,故常用氢氧化钠溶液作为雕刻玻璃的试剂 | |
| D. | 为了提高土壤肥力,往往将碳铵与熟石灰混合使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 2:2:1 | C. | 1:3:2 | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com