
| A. | 它的原子最外层有4个电子 | |
| B. | 它具有+2、+4价 | |
| C. | 金属铜能从114号元素的硝酸盐溶液中置换出该元素的单质 | |
| D. | 它的金属性比铅强 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
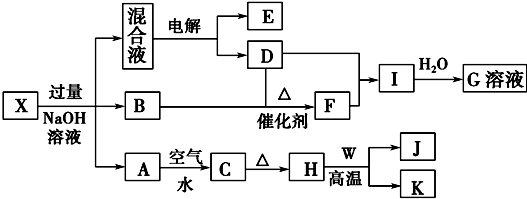
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素元素最外层电子数都是7个,单质化学性质均较稳定 | |
| B. | 卤素元素的单质从上到下熔、沸点依次升高 | |
| C. | 卤素元素的单质从上到下颜色逐渐变浅 | |
| D. | 卤素元素从上到下随电子层数的增多非金属性也依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中碳原子不在一条直线上 | B. | 戊烷有三种同分异构体 | ||
| C. | 丙烷比丁烷更易液化 | D. | 新戊烷的沸点比正戊烷的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH═CH(OH2)2CH3 | B. | CH2═CH(CH2)2CH3 | ||
| C. | CH3CH═CH-CH═CHCH3 | D. | CH3CH2═CHCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不粘锅的原料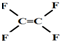 为烃类化合物 为烃类化合物 | |
| B. | 分子组成相差1个或若干个“CH2”原子团的有机物,互称为同系物 | |
| C. | 石油分馏是物理变化,煤的气化、液化是化学变化 | |
| D. | 油脂在酸性或碱性条件下都能发生水解反应制取肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com