
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH,CO,H2的浓度都不再发生变化
E.容器中气体的压强不再改变
(2)表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①写出该反应的平衡常数K的表达式
②由表中数据判断该反应的△H0(填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,5min时达到平衡,测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 , 在0~5min内,以H2表示的平均反应速率为molL﹣1min﹣1 , 平衡时CH3OH的浓度为molL﹣1
【答案】
(1)CDE
(2)K= ![]() ;<;80%;250℃;0.32;0.8
;<;80%;250℃;0.32;0.8
【解析】解:(1)A、无论反应是否达到平衡状态都存在生成CH3OH的速率与消耗CO的速率相等,不能据此判断平衡状态,故错误; B、无论反应是否达到平衡状态,混合气体的密度始终不变,不能据此判断平衡状态,故错误; C、反应前后气体的物质的量减小,混合气体的质量不变,则反应前后混合气体的平均相对分子质量增大,当混合气体的平均相对分子质量不变时,正逆反应速率相等,反应达到平衡状态,故正确; D、CH3OH、CO、H2的浓度都不再发生变化,正逆反应速率相等,反应达到平衡状态,故正确; E、反应前后气体的压强减小,当容器中气体的压强不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;故选CDE;(2)①化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,即K= ![]() ,所以答案是:K=
,所以答案是:K= ![]() ;②升高温度化学平衡常数减小,平衡逆向移动,则正反应是放热反应,△H<0所以答案是:<;③达到平衡状态时n(CO)=0.2mol/L×2L=0.4mol,CO转化率=
;②升高温度化学平衡常数减小,平衡逆向移动,则正反应是放热反应,△H<0所以答案是:<;③达到平衡状态时n(CO)=0.2mol/L×2L=0.4mol,CO转化率= ![]() ×100%=
×100%= ![]() ×100%=80%;开始c(CO)=
×100%=80%;开始c(CO)= ![]() =1mol/L、c(H2)=
=1mol/L、c(H2)= ![]() =3mol/L,
=3mol/L,
CO(g)+ | 2H2(g) | CH3OH(g) | |
开始(mol/L) | 1 | 3 | 0 |
反应(mol/L) | 0.8 | 1.6 | 0.8 |
平衡(mol/L) | 0.2 | 1.4 | 0.8 |
化学平衡常数K= ![]() =2.041,则温度是250℃;
=2.041,则温度是250℃;
v(H2)= ![]() =
= ![]() =0.32mol/(L.min);
=0.32mol/(L.min);
平衡时(CH3OH)=0.8mol/L,
所以答案是:80%;250℃;0.32;0.8.
【考点精析】解答此题的关键在于理解化学平衡状态的判断的相关知识,掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等,以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各组反应中,硝酸既表现了氧化性,又表现了酸性的是
A. C+HNO3B. H2S+HNO3C. Fe(OH)3+HNO3D. Cu+HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | N2 | NO | NO2 | HNO3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Na | NaOH | Na2CO3 | NaHCO3 |
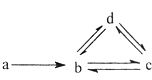
A.①②
B.②③
C.③④
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想用SO2制取少量硫酸,其装置如图所示: 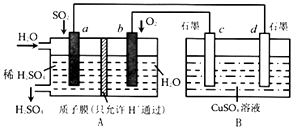
①H+移向极(填“a”或“b”),c极的电极名称是 ,
②a极发生的电极反应式为 .
③c极发生的电极反应式为 .
④标准状况下,A装置吸收3.36LSO2时,B装置中溶液最多减重g.(装置中气体的溶解性忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验装置图、实验操作及结论描述正确的是( )
A.
打开弹簧夹,由漏斗中加水至产生液面差,液面高度差不变时,说明装置气密性良好
B.
打开弹簧夹一段时间后,红墨水倒吸入导气管中,说明铁钉发生了析氢腐蚀
C.
滴入浓硫酸后一段时间,高锰酸钾溶液褪色,说明产生了还原性气体
D.
加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某强氧化剂[RO(OH)2]2+离子2.4×10-3mol被亚硫酸钠还原到较低价态,需12mL0.2mol/L的亚硫酸钠溶液,则反应后R的化合价为( )
A.0B.+2C.+3D.+4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com