
| A. | 乙烯的结构简式:CH2CH2 | B. | .硝基苯的结构简式: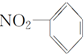 | ||
| C. | 四氯化碳的电子式: | D. | 甲烷分子的比例模型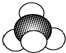 |
分析 A、烯、炔的结构简式碳碳双键、碳碳三键不能省略;
B、硝基书写不规范;
C、四氯化碳的电子式中Cl原子电子没有标全;
D、比例模型体现的是组成该分子的原子间的大小以及分子的空间结构,且碳原子半径大于氢原子.
解答 解:A、乙烯中的碳碳双键不能省略,故乙烯的结构简式为CH2=CH2,故A错误;
B、硝基写在苯环的左边时,应该表示为;O2N-,硝基苯正确的结构简式为: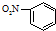 ,故B错误;
,故B错误;
C、四氯化碳分子中含有4个碳氯键,碳原子和氯原子最外层达到8电子稳定结构,四氯化碳正确的电子式为: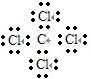 ,故C错误;
,故C错误;
D、甲烷为正四面体结构,碳原子半径大于氢离子,甲烷分子的比例模型为: ,故D正确.
,故D正确.
故选D.
点评 考查常用化学用语的书写判断,题目难度中等,注意掌握常见化学用语的概念及书写原则,明确比例模型突出的是原子之间相等大小以及原子的大致连接顺序、空间结构,不能体现原子之间的成键的情况.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4(aq)+Ba (OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | C (s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1 | |
| D. | C (s,石墨)+$\frac{1}{2}$O2(g)═CO (g)△H=-393.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
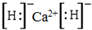 .
.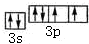 ;D与E能形成一种非极性分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.
;D与E能形成一种非极性分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素(前18号元素)A、B、C、D、E、F在元素周期表中的位置如图所示,其中D为地壳中含量最高的元素.
短周期元素(前18号元素)A、B、C、D、E、F在元素周期表中的位置如图所示,其中D为地壳中含量最高的元素. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠固体溶于水放热 | |
| B. | 红磷在空气中燃烧,产生大量白雾 | |
| C. | 分别蘸有浓盐酸与浓氨水的玻璃棒靠近产生白烟 | |
| D. | 细铁丝在氧气中燃烧,火星四射,生成黑色固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com