
| A. | 该溶液中,K+、Fe2+、I-、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-=Fe2++I2 | |
| C. | 1L0.1mol/L该溶液和足量的Zn充分反应,生成11.2gFe | |
| D. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
分析 A、铁离子和碘离子不能共存;
B、离子方程式要满足电荷守恒;
C、求出硫酸铁的物质的量,然后根据1mol硫酸铁中含2mol铁离子来分析;
D、Fe2(SO4)3和Ba(OH)2按物质的量之比为1:3反应.
解答 解:A、铁离子具有氧化性,该溶液中I-不可以大量共存,故A错误;
B、和KI溶液反应的离子方程式要满足电荷守恒、质量守恒和得失电子数守恒,故正确的离子方程式为:2Fe3++2I-=2Fe2++I2,故B错误;
C、1L 0.1 mol/L该溶液中含有溶质硫酸铁0.1mol,0.1mol硫酸铁中含有0.2mol铁离子,与足量锌反应可以生成0.2mol铁,生成铁的质量为11.2g,故C正确;
D、Fe2(SO4)3和Ba(OH)2按物质的量之比为1:3反应:2Fe3++3SO42-+3Ba2++6OH-═2Fe(OH)3↓+3BaSO4↓故D错误.
故选C.
点评 本题考查了离子共存的判断、离子的性质以及盐的水解原理知识,题目难度中等,注意掌握离子反应发生条件.


科目:高中化学 来源: 题型:解答题
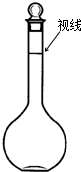 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的数据,请根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的数据,请根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
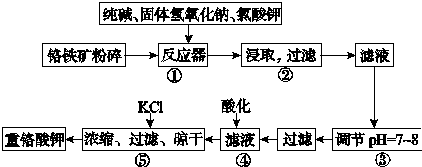
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
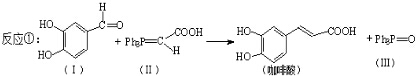
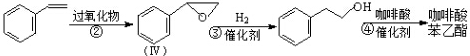
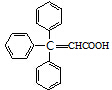 ;咖啡酸苯乙酯的键线式结构简式为
;咖啡酸苯乙酯的键线式结构简式为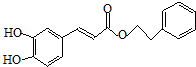 .
.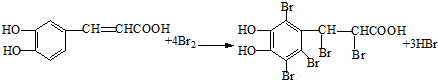 .
.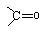
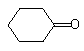 的芳香化合物共有3种
的芳香化合物共有3种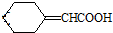 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V一定等于0.2 | |
| B. | V大于或等于0.2,也有可能小于0.2 | |
| C. | 混合溶液中离子浓度一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 混合溶液中离子浓度可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com