
| A. | 10a+b-14 | B. | 1014-a-b | C. | 1014+a-b | D. | 10a+b+14 |
科目:高中化学 来源: 题型:解答题
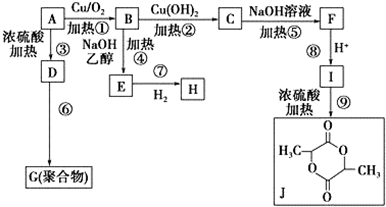
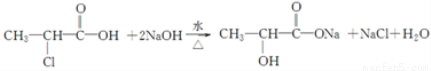 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- | |
| B. | 2Fe2++4I-+4Br-+5Cl2═2Fe3++2I2+2Br2+10Cl- | |
| C. | 2Fe2++2I-+2Br-+3Cl2═2Fe3++I2+Br2+6Cl- | |
| D. | 2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
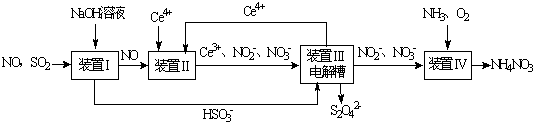
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 在pH=0的溶液中:Na+、NO3-、SO32-、K+ | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用高氯酸与碳酸钙反应制取二氧化碳可证明氯元素非金属性大于碳元素 | |
| B. | 糖类、油脂、蛋白质在一定条件下都能发生水解反应 | |
| C. | 硅单质在电子工业上应用广泛,可做光导纤维 | |
| D. | 石油的裂化产生气体、植物油以及苯甲酸均能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
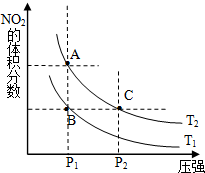 (1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).
(1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com