
【题目】在某2 L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g)![]() 3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
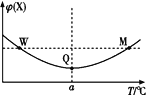
A.M点时,Y的转化率最大B.升高温度,平衡常数减小
C.W点时 v正 = v逆D.W、M两点Y的正反应速率相同
【答案】B
【解析】
温度在a℃之前,升高温度,X的含量减小,温度在a℃之后,升高温度,X的含量增大,曲线上最低点为平衡点,最低点之前未达平衡,反应向正反应进行,最低点之后,各点为平衡点,升高温度X的含量增大,平衡向逆反应方向移动,故正反应为放热反应,据此分析解答。
A.曲线上最低点Q为平衡点,升高温度平衡向逆反应移动,Y的转化率减小,所以Q点时,Y的转化率最大,故A错误;
B.Q点后升高温度平衡逆向移动,正反应为放热反应,则升高温度,平衡常数减小,故B正确;
C.W点不是平衡点,此时反应以正向进行为主,即v正 > v逆,故C错误;
D.W点对应的温度低于M点对应的温度,温度越高反应速率越大,所以W点Y的正反应速率小于M点Y的正反应速率,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】在下列叙述的方法中,能将有机化合物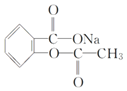 转变为
转变为 的有( )
的有( )
A.跟足量的NaOH溶液共热后,再通入二氧化碳直至过量
B.把溶液充分加热后,通入足量的二氧化硫
C.与稀H2SO4共热后,加入足量NaOH溶液
D.与稀H2SO4共热后,加入足量NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
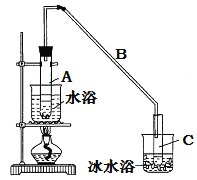
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知:![]()
![]()
![]() +H2O
+H2O
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品:将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_________________________。
②导管B除了导气外还具有的作用是_____________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水应从_________口进入,目的是使冷却水与气体形成逆流方向。
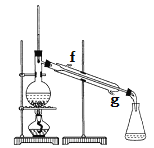
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是__________。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗硅提纯常见方法之一是先将粗硅与HCl反应制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
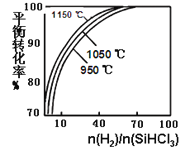
A. X是H2
B. 1150℃反应的平衡常数大于950℃时反应的平衡常数
C. 减小Si(s)的量,有利于提高SiHCl3的转化率
D. 工业上可采用增大压强的方法提高产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。
(2)B中质子数和中子数相等的核素符号为____,E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是______L(标准状况下)。
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.新制氯水长时间放置颜色变浅
B.高压比常压更有利于 SO2 转化为 SO3
C.蒸干 AlCl3 溶液无法得到无水 AlCl3
D.滴加少量 CuSO4 溶液可以加快 Zn 与稀 H2SO4 反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。完成下列填空:
(1)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),其他产物性质稳定。该反应中被氧化与被还原的元素的原子个数之比为______。如果反应中有5mol电子发生转移,可得到肼______g。
(2)常温下向25mL1.00mol/L稀盐酸中缓缓通入0.025molNH3(溶液体积变化忽略不计),反应后溶液中离子浓度由大到小的顺序是_____。在通入NH3的过程中溶液的导电能力____(填写“变大”、“变小”或“几乎不变”)。
(3)向上述溶液中继续通入NH3,该过程中离子浓度大小关系可能正确的是_____(选填编号)。
a.[Cl-]=[NH4+]>[H+]=[OH-] b.[Cl-]>[NH4+]=[H+]>[OH-]
c.[NH4+]>[OH-]>[Cl-]>[H+] d.[OH-]>[NH4+]>[H+]>[Cl-]
(4)常温下向25mL含HCl0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡____(填写电离平衡移动情况)。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为______mol·L-1。
(5)设计两种实验方案证明氨水是弱电解质(1)_______;(2)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3 和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
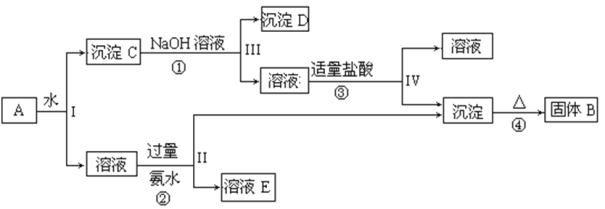
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是____________。
(2)根据上述框图反应关系,写出下列B、C、D所含物质的化学式固体B _______; 沉淀C ________ ; 沉淀D ________;
(3)写出①、②、③的离子方程式和④的化学方程式:
①__________________________________________
②_________________________________________
③_________________________________________
④ ________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示吸热反应、置换反应、氧化还原反应之间的关系,从下列选项反应中选出属于区域V的是( )
![]()
A.Na2O2+2CO2=Na2CO3+O2B.NaOH+HCl=NaCl+H2O
C.2NaHO3=2Na2CO3+H2O+CO2↑D.2Na+2H2O=NaOH+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com