
| A. | 将一定体积醋酸溶液加水到原来体积的m倍,则pH增大m | |
| B. | 在NaHCO3溶液中,c(Na+)=c(HCO3-)+c(H2CO3) | |
| C. | 25℃,pH=8的NaOH溶液和pH=8的氨水中,由水电离出的c(OH-)不相等 | |
| D. | 25℃,pH=13的Ba(OH)2溶液和pH=1的盐酸中均存在:c(H+)•c(OH-)=1×10-14 |
分析 A.醋酸为弱电解质,稀释后醋酸的电离程度增大,溶液中c(H+)大于原来的$\frac{1}{m}$,且溶液无限稀释时溶液接近中性;
B.HCO3-能电离也能水解,则溶液中存在含有C元素的微粒有HCO3-、H2CO3、CO32-;
C.酸或碱抑制水电离,相同温度下,不同碱溶液中只要c(OH-)相同,则其抑制水电离程度相同;
D.相同温度下,任何电解质溶液中水的离子积常数都相同.
解答 解:A.醋酸为弱电解质,稀释后醋酸的电离程度增大,溶液中c(H+)大于原来的$\frac{1}{m}$,且溶液无限稀释时溶液接近中性,所以将一定体积醋酸溶液加水到原来体积的m倍,则pH不增大m,故A错误;
B.HCO3-能电离也能水解,则溶液中存在含有C元素的微粒有HCO3-、H2CO3、CO32-,根据物料守恒得c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C.酸或碱抑制水电离,相同温度下,不同碱溶液中只要c(OH-)相同,则其抑制水电离程度相同,所以25℃,pH=8的NaOH溶液和pH=8的氨水中,由水电离出的c(OH-)相等,故C错误;
D.相同温度下,任何电解质溶液中水的离子积常数都相同,所以25℃,pH=13的Ba(OH)2溶液和pH=1的盐酸中均存在:c(H+)•c(OH-)=1×10-14,故D正确;
故选D.
点评 本题考查离子浓度大小比较、弱电解质的电离等知识点,为高频考点,侧重考查学生分析判断能力,明确盐类水解、弱电解质的电离特点是解本题关键,注意:水的离子积常数只与温度有关,与溶液酸碱性及浓度无关,易错选项是AD.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
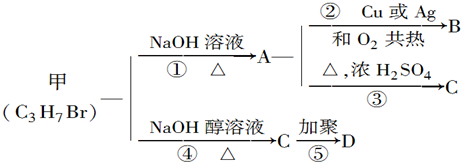
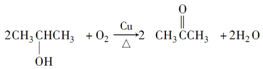

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氢原子的氢气在标准状况下的体积约为22.4L | |
| B. | 25℃,1.01×105 Pa,64g SO2中含有的原子数为3NA | |
| C. | 2.3g金属钠变为钠离子失去电子数为0.05NA | |
| D. | 标准状况下,11.2LH2O 含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2 | B. | Na2CO3 | C. | 氯水 | D. | NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素最高正化合价为+2 | B. | 该元素原子核外共有5个电子层 | ||
| C. | 该元素原子的M能层共有8个电子 | D. | 该元素原子最外层共有3个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能大于O原子 | N原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为120° |
| C | 金刚石的熔点低于石墨 | 金刚石是原子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳通入苯酚钠溶液能游离出苯酚 | |
| B. | 与FeCl3溶液发生显色反应 | |
| C. | 与NaOH溶液反应 | |
| D. | 常温下苯酚在水中的溶解度不大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com