
【题目】下图是元素周期表的一部分,表中所列的字母分别代表某一化学元素。

完成下列填空(填元素符号或化学式):
(1)上图中元素C在周期表中的位置是___________,G和I形成的化合物不止一种,其中一种物质中各原子最外层均达到8电子稳定结构,请写出其电子式______________。
(2)请按照由大到小的顺序写出B、C、D的简单离子的离子半径大小顺序_______(用离子符号表示),上述元素中最高价氧化物对应的水化物中酸性最强的物质的化学式为___________ 。
(3)请写出D的最高价氧化物对应的水化物和F的单质反应时的离子方程式____________。
(4)元素周期表位于对角线的两种元素其性质相似称之为对角线规则。根据周期表对角线规律,金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。则鉴别Be(OH)2和Mg(OH)2可选用的试剂为NaOH溶液,发生反应的化学方程式为___________。
(5)下列能说明氯元素原子得电子能力比硫元素原子得电子能力强的是___________。
① HCl的稳定性比H2S的强,② Cl2能与H2S反应生成S,③HCl的溶解度比H2S的大,④还原性:Cl-<S2-,⑤HClO4的酸性比H2SO4的强,⑥HCl的酸性比H2S的强,⑦Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
【答案】第2周期第VIA族  N3->O2->Na+ HClO4 2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑或2Al + 2OH - + 6H2O = 2A(lOH)4- + 3H2↑ Be(OH)2+2NaOH - =Na2BeO2+2H2O ①②④⑤⑦
N3->O2->Na+ HClO4 2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑或2Al + 2OH - + 6H2O = 2A(lOH)4- + 3H2↑ Be(OH)2+2NaOH - =Na2BeO2+2H2O ①②④⑤⑦
【解析】
根据元素在周期表中的位置可知,A为H元素,B为N元素,C为O元素,D为Na元素,E为Mg元素,F为Al元素,G为P元素,H为S元素,I为Cl元素,结合元素周期律分析解答。
(1)上图中元素C为O元素,在周期表中位于第2周期第VIA族;G和I形成的化合物有三氯化磷和五氯化磷等,其中一种物质中各原子最外层均达到8电子稳定结构,该物质为三氯化磷,三氯化磷的电子式为![]() ,故答案为:第2周期第VIA族;
,故答案为:第2周期第VIA族;![]() ;
;
(2)B为N元素,C为O元素,D为Na元素,简单离子的电子层结构相同,电子层数相同的离子,原子序数越大,半径越小,离子半径N3->O2->Na+,上述元素中最高价氧化物对应的水化物中酸性最强的物质为高氯酸,化学式为HClO4,故答案为:N3->O2->Na+;HClO4;
(3)D的最高价氧化物对应的水化物为氢氧化钠,F的单质为铝,二者反应时的离子方程式为2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑或2Al + 2OH - + 6H2O = 2A(lOH)4- + 3H2↑,故答案为:2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑或2Al + 2OH - + 6H2O = 2A(lOH)4- + 3H2↑;
(4)根据周期表对角线规律,金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。可选用的试剂为NaOH溶液鉴别Be(OH)2和Mg(OH)2,Be(OH)2能够被NaOH溶解,而Mg(OH)2不能,反应的化学方程式为Be(OH)2+2NaOH - =Na2BeO2+2H2O,故答案为:Be(OH)2+2NaOH - =Na2BeO2+2H2O;
(5)①元素的非金属性越强,对应氢化物的稳定性越强,氯化氢比硫化氢稳定,可说明氯元素的非金属性比硫元素强,能说明氯元素原子得电子能力比硫强,故正确;
②元素的非金属性越强,对应单质的氧化性越强,氯气与H2S能发生置换反应,说明氯气的氧化性大于S,元素的非金属性Cl大于S,能说明氯元素原子得电子能力比硫强,故正确;
③物质的溶解性属于物理性质,与元素的非金属性及得电子能力无关,所以HCl的溶解度比H2S大,不能说明氯元素原子得电子能力比硫强,故错误;
④阴离子的还原性越强,对应元素的非金属性越弱,还原性:Cl-<S2-,元素的非金属性Cl大于S,能说明氯元素原子得电子能力比硫强,故正确;
⑤元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,HClO4的酸性比H2SO4的强,说明元素的非金属性Cl大于S,能说明氯元素原子得电子能力比硫强,故正确;
⑥不能根据氢化物的水溶液的酸性强弱比较非金属性,例如HI的酸性比HCl强,但非金属性Cl>I,故错误
⑦单质与同种金属反应生成的产物的价态越高,说明氧化性越强,则非金属性越强,所以Cl2与铁反应生成FeCl3,而S与铁反应生成FeS,说明氯气的氧化性大于S,元素的非金属性Cl大于S,能说明氯元素原子得电子能力比硫强,故正确;
能说明氯元素原子得电子能力比硫元素原子得电子能力强的有①②④⑤⑦,故答案为:①②④⑤⑦。


科目:高中化学 来源: 题型:
【题目】(1)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用。真空碳热还原一氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g);△H= a kJmol-1
3AlCl(g)= 2Al(l)+ AlCl3(g);△H= b kJmol-1
反应Al2O3(s)+ 3C(s)= 2Al(l)+ 3CO(g)的△H=______ kJmol-1(用含a、b的代数式表示)。
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,试回答下列问题:
①若起始时c(CO)=2molL﹣1,c(H2O)=3molL﹣1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=__.
②在相同温度下,若起始时c(CO)=1molL﹣1,c(H2O)=2molL﹣1,反应进行一段时间后,测得H2的浓度为0.5molL﹣1,则此时该反应是否达到平衡状态__(填“是”与“否”),此时v(正)__v(逆)(填“大于”“小于”或“等于”),你判断的依据是____________________
③若降低温度,该反应的K值将__,该反应的化学反应速率将__(均填“增大”“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2O2的叙述不正确的是( )
A.1 mol Na2O2与足量CO2反应转移的电子为1 mol
B.将10 g H2和CO的混合气体充分燃烧,将生成物(H2O、CO2)通入足量的Na2O2固体中充分反应,固体增重为10 g
C.将Na2O2投入FeSO4溶液中生成红褐色沉淀
D.将等物质的量的NaHCO3和Na2O2混合后,在密闭容器中充分加热排除气体后剩余固体为Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+物质的量分别为

A. 2 mol、3 mol、6 mol B. 3 mol、2 mol、6mol
C. 2 mol、3 mol、4 mol D. 3 mol、2 mol、2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的表示方法中错误的是
A. 次氯酸的电子式: ![]()
B. M2+离子核外有 a个电子,b个中子,M 原子符号为a+b+2a+2M
C. 用电子式表示MgCl2 的形成过程为 ![]()
D. Na+的结构示意图:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可成甘油、医药、农药香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的价电子排布式为___________________。
(2)1 mol CH2=CH-CH2OH含__________molσ键,烯丙醇分子中碳原子的杂化类型为_____________。
(3)丙醛(CHCH2CHO)的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是_______________________________。
(4)羰基镍[Ni(CO)4)用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是_________________。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2-和[Ni(SCN)2]-等。NH3的空间构型是_____________,与SCN-互为等电子体的分子为____________。
(6)“NiO”晶胞如图所示。

①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为____________。
②已知:氧化镍晶胞密度为dg·cm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为__________nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀示意图如图所示情形的是(注意线段的斜率)
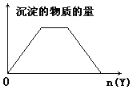
A. 向含NaOH的NaAlO2溶液中滴加盐酸
B. 向HCl和AlCl3的混合液中滴加NaOH
C. 向NH4Cl和AlCl3的混合液中滴加NaOH
D. 向NaOH和Ca(OH)2的混合液中通入CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当温度和压强一定时,决定气体体积大小的主要因素是( )
A. 分子数目的多少 B. 分子间距离的大小
C. 分子间引力的大小 D. 分子直径的大小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com