
【题目】溶液的酸碱性可用酸度![]() 表示,AG=lg
表示,AG=lg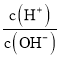 。室温下,将
。室温下,将![]() 盐酸逐滴滴人
盐酸逐滴滴人![]()
![]()
![]() 氨水中,溶液的AG变化如图所示。下列说法正确的是( )
氨水中,溶液的AG变化如图所示。下列说法正确的是( )
A.室温下,![]()
![]() 盐酸的
盐酸的![]()
B.M点时溶液中:![]()
C.M点加入盐酸的体积大于![]() mL
mL
D.M点以后NH4+的水解程度逐渐增大
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
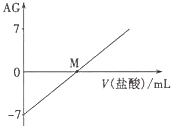
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )
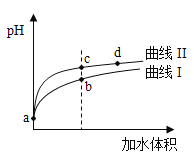
A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中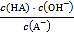 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是( )
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图所示:

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:___________________________。
(2)写出C的酸性溶液与双氧水反应的离子方程式:__________________________________。
(3)写出鉴定E中阳离子的实验方法和现象:_______________________________________。
(4)有学生利用FeCl3溶液制取FeCl3·6H2O晶体,主要操作包括:滴入过量盐酸,_________、冷却结晶、过滤。过滤操作除了漏斗、烧杯,还需要的玻璃仪器为_______________________。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(1)H3PO2及其与足量氢氧化钠反应生成的NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①在H3PO2中,磷元素的化合价为________在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:________(填化学式)。
②NaH2PO2是________(填“正盐”或“酸式盐”),其溶液中离子浓度由大到小的顺序应为________
(2)次磷酸(H3PO2)可以通过电解的方法制备.工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
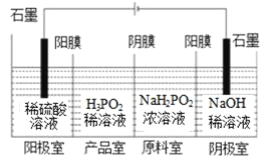
①写出阳极的电极反应式________
②分析产品室可得到H3PO2的原因________(结合一定的文字分析)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.1 mol·L-1 H2A溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列叙述错误的是
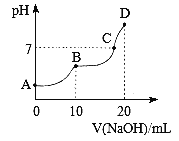
A. C点溶液中含有NaHA和Na2A
B. NaHA溶液中水的电离程度比Na2A溶液中小
C. B点,c (Na+)=2[c (H2A)+c (HA)+c (A2-)]
D. D点,c (Na+)>c (A2-)>c (OH-)>c (HA-)>c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置分别进行如下实验,各离子方程式正确及各组物质反应后,溶液的导电性比反应前增强的是( )
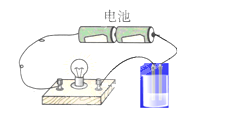
A.向硝酸银溶液中通入少量氯化氢:Ag++Cl-=AgCl↓
B.向亚硫酸溶液中通入氯气:H2SO3+C12+H2O=SO42-+4H++2Cl-
C.向FeBr2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-
D.向NaOH溶液中通入少量氯气:2OH-+Cl2=Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
醋酸在水溶液中的电离方程式为 ______________________。
(2)用 0.1 mol·L-1NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
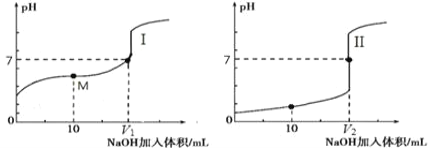
①滴定醋酸的曲线是_______________(填“I”或“II”)。
②室温时,若 0.1 mol·L-1的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________________。
④上述用 0.1 mol·L-1的 NaOH 溶液滴定 0.1 mol·L-1的盐酸,下列操作不正确的是____________________________。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定绝不能用___________作指示剂,若使用酚酞作指示剂则滴定终点的现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
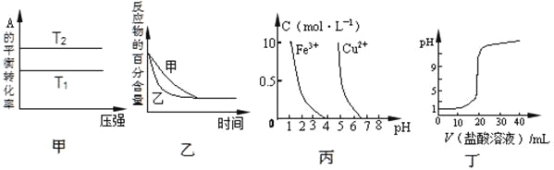
A.由图甲可以判断:若T1>T2,反应A(g)+ B(g)![]() 2C(g)的△H<0
2C(g)的△H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com