
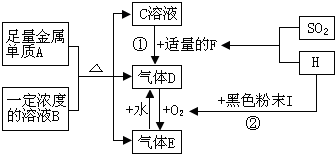
分析 A是日常生活中应用最广、用量最大的金属单质,则A为Fe;与一定浓度B溶液反应得到C及气体D、气体E,结合D与E相互转化可知,B为HNO3、D为NO、E为NO2,二氧化硫与H反应得到强酸F,F与C反应得到NO,则C为Fe(NO3)2,H与黑色粉末I可以得到氧气,故H为H2O2,I为MnO2,F为H2SO4,据此解答.
解答 解:A是日常生活中应用最广、用量最大的金属单质,则A为Fe;与一定浓度B溶液反应得到C及气体D、气体E,结合D与E相互转化可知,B为HNO3、D为NO、E为NO2,二氧化硫与H反应得到强酸F,F与C反应得到NO,则C为Fe(NO3)2,H与黑色粉末I可以得到氧气,故H为H2O2,I为MnO2,F为H2SO4.
(1)由上述分析可知,B为HNO3,E为NO2,故答案为:HNO3;NO2;
(2)H2O2和 SO2生成强酸H2SO4,此反应中氧化剂是H2O2,故答案为:H2O2;
(3)反应①的离子方程式:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(4)反应②的化学方程式:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
(5)Fe(NO3)2溶液中滴入NaOH溶液,所发生反应的化学方程式为:Fe(NO3)2+2NaOH═Fe(OH)2↓+2 NaNO3、4Fe(OH)2+O2+2H2O═4Fe(OH)3,现象为:先产生白色沉淀,迅速变为灰绿色,最后变为红褐色沉淀,
故答案为:先产生白色沉淀,迅速变为灰绿色,最后变为红褐色沉淀;Fe(NO3)2+2NaOH═Fe(OH)2↓+2 NaNO3、4Fe(OH)2+O2+2H2O═4Fe(OH)3.
点评 本题考查无机物推断,涉及N、Fe、S元素单质化合物性质,是对学生综合能力的考查.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:多选题
| A. | 加热浓氨水 | B. | 加热NH4Cl固体 | ||
| C. | 加热NH4Cl和Ca(OH)2的混合物 | D. | 加热小苏打固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类的分子通式为 Cm(H2O)n | B. | 糖类物质都有甜味 | ||
| C. | 蔗糖不是淀粉水解的产物 | D. | 糖类一般都能水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①为氧化还原反应,反应②为复分解反应 | |
| B. | 反应①中物质氧化性的强弱顺序是:NaClO>Na2FeO4>FeCl3 | |
| C. | 若有2mol FeCl3 发生反应,转移电子的物质的量为 6mol | |
| D. | Na2FeO4能杀菌消毒是因为溶于水产生Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向能使pH试纸显深蓝色的溶液中通入少量二氧化碳:OH-+CO2═HCO3- | |
| B. | 向NaClO溶液中加入浓氢溴酸:ClO-+2H++2 Br-═Cl-+Br2+H2O | |
| C. | 向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向FeBr2溶液中滴加少量Cl2溶液:2 Br-+Cl2═Br2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
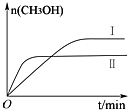 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com