
| A. | 氧化铝、氧化铁均为两性氧化物 | |
| B. | 氧化铝中的微粒半径:r(Al3+)>r(O2-) | |
| C. | 在该反应中,铝的还原性强于铁的还原性 | |
| D. | 1mol 氧化铁参加反应转移电子数约为4×6.02×1023 |
分析 A.氧化铁是碱性氧化物;
B.电子排布相同的微粒,原子序数越大,微粒半径越小;
C.氧化还原反应中还原剂的还原性大于还原产物的还原性;
D.根据化合价的变化判断.
解答 解:A.氧化铝为两性氧化物,氧化铁是碱性氧化物,故A错误;
B.电子排布相同的微粒,原子序数越大,微粒半径越小,则微粒半径:r(O2-)>r(Al3+),故B错误;
C.氧化还原反应中还原剂的还原性大于还原产物的还原性,2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,反应中Al作还原剂,所以铝的还原性强于铁的还原性,故C正确;
D.Fe2O3中Fe元素的化合价为+3价,反应后变为0价,所以1mol氧化铁参加反应得到6mol 电子,转移电子数约为6×6.02×1023,故D错误.
故选C.
点评 本题考查氧化还原反应、微粒半径比较,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应中基本概念,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 物质变化 | 能量关系 | |
| A | 将充满NO2的针筒置于热水中,气体颜色变深 | 1molN2O4(g)的能量>2molNO2(g)的能量 |
| B | 将NaOH溶液与HCl溶液混合 | 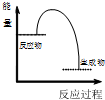 |
| C | 1g气态SiH4在空气中燃烧,生成SiO2 (s)与液态水,放热44.6kJ | SiH4(g)+2O2(g)→SiO2(s)+2H2O(l)+44.6kJ |
| D | 合成氨:N2(g)+3H2(g)?2NH3(g)+92.4kJ | 反应物的总键能>生成物的总键能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
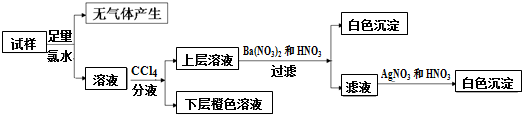
| A. | 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 | |
| B. | 无法确定原溶液中是否存在Cl- | |
| C. | 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定 | |
| D. | 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离Fe2O3、Al2O3操作依次为溶解、过滤、灼烧 | |
| B. | 粗盐可通过溶解、过滤、蒸发、结晶的方法提纯 | |
| C. | 配制氯化铁溶液,是将FeCl3溶于蒸馏水,再加入一定量的铁粉 | |
| D. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水溶解氯化银沉淀:AgCl+2NH3•H2O=[Ag(NH3)2]++Cl-+2H2O | |
| B. | CH3COOH溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 酸性K2Cr2O7溶液氧化双氧水:Cr2O72-+8H++5H2O2=2 Cr3++4O2↑+9H2O | |
| D. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
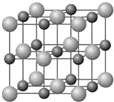 原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24.
原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3溶液中加入等浓度等体积的盐酸:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | NaHS溶液中:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | pH相同的①CH3COONa溶液、②NaClO溶液中c(Na+):①<② | |
| D. | pH=9的0.1mol•L-1的NaHR溶液中:c(HR-)>c(H+)>c(R2-)>c(H2R) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl沉淀生成和溶解同时在不断进行,且速率相等 | |
| B. | AgCl难溶于水,则溶液中没有Ag+和Cl- | |
| C. | 只要向含有AgCl的饱和溶液中加入盐酸,一定会有沉淀生成 | |
| D. | 向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com