
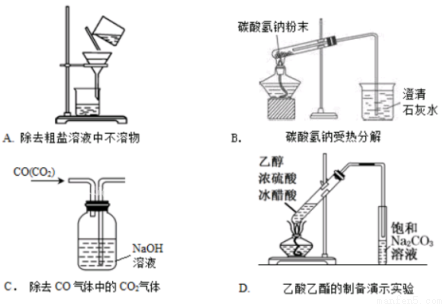
下列图示实验正确的是
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(福建卷解析版) 题型:填空题
(15分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液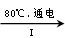 NaClO3溶液
NaClO3溶液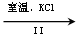 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。
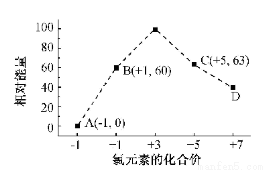
①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(江苏卷解析版) 题型:填空题
(14分)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
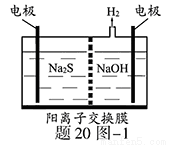
(1)将烧碱吸收H2S后的溶液加入到如题20图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e- S (n—1)S+ S2-
S (n—1)S+ S2- Sn2-
Sn2-
①写出电解时阴极的电极反应式: 。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成 。
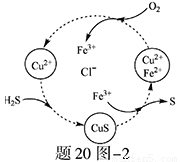
(2)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如题20图—2所示。
①在图示的转化中,化合价不变的元素是 。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为 。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有 。
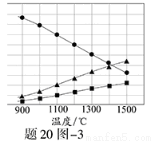
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题20图—3所示,H2S在高温下分解反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(江苏卷解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:Na+、K+、MnO4-、CO32-
B.c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3-
C.0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl-
D.0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标Ⅱ卷解析版) 题型:填空题
(15分)(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第 周期.第 族;PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ;PbO2也可以通过石墨为电极,Pb(NO3)2 和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 ,这样做的主要缺点是 。
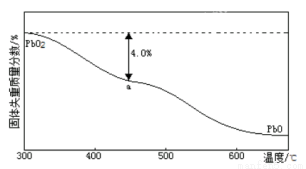
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重的4.0%(即样品起始质量—a点固体质量/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2 ·nPbO,列式计算x值和m:n值 。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标I卷解析版) 题型:填空题
〔化学—选修3:物质结构与性质〕(15分)
早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾奉验三价铁离子,形成配合物的颜色为
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为 ;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标I卷解析版) 题型:选择题
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
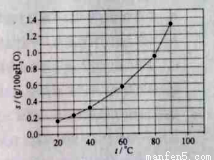
A.溴酸银的溶解时放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(山东卷解析版) 题型:填空题
(12分)【化学—有机化学基础】
3﹣对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
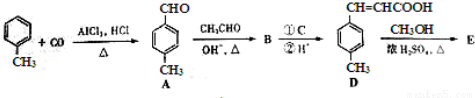
已知:HCHO+CH3CHO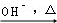 CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)遇FeCl3溶液显紫色且苯环上有两个取代基的A的同分异构体有 _________ 种,B中含氧官能团的名称为 _________ .
(2)试剂C可选用下列中的 _________ .
a、溴水
b、银氨溶液
c、酸性KMnO4溶液
d、新制Cu(OH)2悬浊液
(3)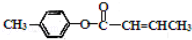 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 _________ .
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 _________ .
(4)E在一定条件下可以生成高聚物F,F的结构简式为 _________ .
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(四川卷解析版) 题型:选择题
下列实验方案中,不能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液用稀HNO3酸化加入AgNO3溶液,观察是否产生淡黄色沉淀 |
B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色 |
D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com