
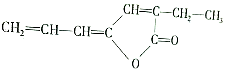
 ,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题:
,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题:分析  中含有的官能团为碳碳双键和酯基,由于其分子中含有O原子,不属于烃,含有碳碳双键,能够发生加成反应;根据该有机物的结构简式判断其分子式.
中含有的官能团为碳碳双键和酯基,由于其分子中含有O原子,不属于烃,含有碳碳双键,能够发生加成反应;根据该有机物的结构简式判断其分子式.
解答 解:(1)a.该有机物分子中含有O元素,不属于烃,故a错误;
b.该物质中不含苯环,不属于芳香烃,故b错误;
c.该物质中含有碳碳双键,能与H2发生加成反应,故c正确;
d.该物质含有碳碳双键、酯基2种官能团,故d错误;
故答案为:c;
(2) 中含有的官能团为:碳碳双键、酯基,
中含有的官能团为:碳碳双键、酯基,
故答案为:碳碳双键、酯基;
(3)根据结构简式 可知,该有机物分子中含有9个C、10个H和2个O原子,其分子式为:C9H10O2,
可知,该有机物分子中含有9个C、10个H和2个O原子,其分子式为:C9H10O2,
故答案为:C9H10O2.
点评 本题考查了有机物结构与性质,题目难度中等,明确常见有机物结构与性质为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
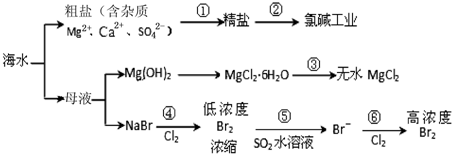
| A. | 除去粗盐中杂质(Mg2+、Ca2+、SO42-),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 | |
| D. | 从第④步到第⑥步的目的是为了浓缩富集溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体所含分子数之比为1:1 | |
| B. | 两种气体的摩尔质量之比为1:1 | |
| C. | 两种气体所含原子数之比为1:1 | |
| D. | 两种气体所含的氧原子的摩尔质量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | II A | III A | IV A | VA | VI A | VII A |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com