
科目:高中化学 来源: 题型:解答题
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
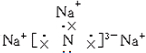 ,该化合物由离子键形成.
,该化合物由离子键形成. ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
 ;G、H 氢化物的稳定性递减的顺序是HCl>HBr.
;G、H 氢化物的稳定性递减的顺序是HCl>HBr. ;.
;. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-丁二烯(CH2=CH-CH=CH2)与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下与足量硝酸发生硝化反应 | |
| D. | 乙醇与HBr发生的取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油酸的分子式为C18H33O2 | B. | 油酸是乙酸的同系物 | ||
| C. | 油酸可与氢气发生加成反应 | D. | 1 mol甘油最多可与1 mol油酸酯化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L氧气中,一定含有2mol氧原子 | |
| B. | 80 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L | |
| C. | 18 g水在标准状况下的体积约为22.4L | |
| D. | 标准状况下,20 mLNH3跟60 mLO2所含分子个数比为1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com