
【题目】常温下,向10 mL 0.1 mol/L的HR溶液中逐滴滴入0.l mol/L 的氨水,溶液pH及导电性变化如图。
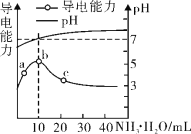
下列分析正确的是
A.HR为强酸
B.加入10 mL 氨水时,溶液中c(NH4+)>c(R-)
C.c点溶液存在c(NH4+)<c( R-)
D.b点的离子浓度大于a点的离子浓度
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】我国是镁资源最为丰富的国家之一.
(1)将1mol镁铝合金(Mg17Al12)完全溶解于12L 6mol/L的盐酸中,放出氢气______mol,为使反应后溶液中的Mg2+、Al3+完全沉淀,需加入10mol/L的氨水至少______L。
(2)灼烧碱式碳酸镁可得到MgO.取碱式碳酸镁4.66g,灼烧至恒重,得到2g固体和1.76g CO2,某学生为确定碱式碳酸镁的化学式列了以下联立方程:
24+17x+60y+18z=4.66÷(![]() )…①
)…①
2﹣x﹣2y=0…②
(![]() )×(0.5x+z)×18=4.66﹣2﹣1.76…③
)×(0.5x+z)×18=4.66﹣2﹣1.76…③
(a)①式表达的是求算碱式碳酸镁摩尔质量的关系式,则②式表达的是_______________;
(b)以上关系式是正确的,据此可求出该碱式碳酸镁的化学式为________________________________。
(3)氧化镁可用于烟气脱硫,反应原理为:
MgO+H2O=Mg(OH)2 Mg(OH)2+SO2=MgSO3+H2O
MgSO3+H2O+SO2=Mg(HSO3)2 2MgSO3+O2=2MgSO4
某小组模拟脱硫过程如下(实验在25℃进行):将MgO加入水中,不断搅拌,通入SO2和空气,得到550g滤液和若干克滤渣.取55g滤液依次加入足量的盐酸和BaCl2溶液,得到0.897g白色沉淀;另取55g滤液加入足量氯水和BaCl2混合溶液,得到1.992g白色沉淀.分析知滤渣中含MgSO3 16.82g(其它成分不含硫元素)。
①该实验过程中吸收的SO2的物质的量为________mol;消耗氧气的物质的量为_______mol。
②Mg(HSO3)2易溶于水;25℃溶解度,MgSO4:33.7g/100g水;MgSO3:0.652g/100g水.试通过计算确定550g滤液中镁盐的成分及物质的量(写出计算过程)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中的没食子儿茶素(EGC)结构如图所示.关于EGC的下列叙述中正确的是( )
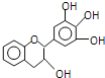
A.EGC的分子式为C15H14O5,属于芳香烃类化合物
B.1molEGC与4molNaOH恰好完全反应
C.该物质能够发生取代反应、加成反应、氧化反应、还原反应、显色反应
D.分子中所有的原子处在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在玻璃生产中,熔炉里原料发生的主要反应为:2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+CO2↑
2Na2SiO3+CaSiO3+CO2↑
(1)某反应物在熔融状态下不导电,它属于___晶体。
(2)上述反应里所涉及的短周期元素原子半径由大到小的顺序为___。
(3)碳和硅属于同族元素,该族元素的原子最外层轨道表示式为___。
(4)写一个能比较碳元素和氧元素非金属性强弱的化学反应方程式:___。
(5)CO2的电子式为___。
(6)反应物Na2CO3和CaCO3均能制备二氧化碳,但是往往不是都能使用稀硫酸,请说明理由:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用食盐水制取ClO2的工业流程如图所示。

装置①中的反应:![]()
装置②中的反应:![]()
下列关于该流程的说法正确的是
A.该流程中仅NaCl可循环利用
B.装置①中H2是阴极产物
C.装置②中Cl2是还原产物
D.为使H2完全转化为HCl,还应向装置③中再补充Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿垃圾又称为厨余垃圾,厨余垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子)。 下列说法正确的是( ).
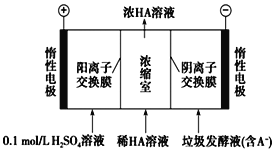
A.当有11.2LO2生成时,电路中通过2 mol e-的电量
B.电子从负极经电解质溶液回到正极
C.通电后,A-通过阴离子交换膜从阴极区进入浓缩室
D.通电后,阳极附近pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用SO2除去原料气中少量CO生成物为S和氧和CO2。
(1)写出该反应的化学方程式为__________________________________________
(2)上述反应中,每减少2.24L气体(标准状况下)转移电子数为________________。
(3)上述反应所涉及的三种元素中原子半径从大到小的排列顺序为______________;三种元素非金属性由强到弱的顺序为__________________;反应所涉及的化合物中仅有一种是非极性分子,其电子式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36g炭不完全燃烧所得气体中CO和CO2的体积比为1:2。已知:
C(s)+1/2O2(g) === CO(g); △H1=-110.35kJ/mol
CO(g)+1/2O2(g) === CO2(g);△H2=-282.57kJ/mol
则与36g炭完全燃烧相比,损失的热量是( )
A.392.93kJB.282.57kJC.784.92kJD.3274.3kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com