
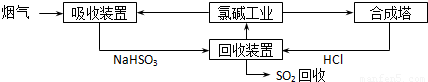
| 分析推测 | 实验步骤 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2) 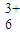 (反应b) (反应b) | ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
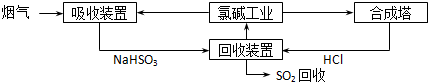
| 分析推测 | 实验步骤 | ||
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2)
|
ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
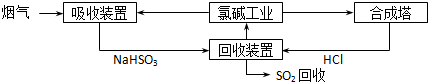
| 分析推测 | 实验步骤 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2) 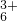 (反应b) (反应b) | ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源:东城区二模 题型:填空题
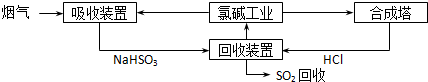
| 分析推测 | 实验步骤 | ||
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2)
|
ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
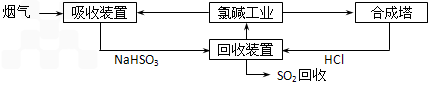

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com